Adamh

Is é is adamh ann ná an chuid is lú de dhúil a fhéadann páirt a ghlacadh in athrú ceimiceach. Tá gach solad, leacht, gás agus plasma comhdhéanta d’adamh neodrach nó ianaithe. Tá adaimh thar a bheith beag, de ghnáth timpeall 100 piciméadar trasna. Tá siad chomh beag sin nach féidir a n-iompar a thuar go cruinn ag baint úsáide as an bhfisic chlasaiceach — amhail is dá mba liathróidí leadóige iad, mar shampla - mar gheall ar éifeachtaí candamacha.
Tá gach adamh comhdhéanta de núicléas agus leictreon amháin nó níos mó atá ceangailte leis an núicléas. Tá an núicléas déanta as prótón amháin nó níos mó agus roinnt neodrón. An t-aon adamh gan neodróin is ea an t-adamh hidrigine is coitianta. Tá níos mó ná 99.94% de mhais an adaimh sa núicléas. Tá lucht leictreach dearfach ag na prótóin agus lucht leictreach diúltach ag na leictreoin. Níl aon lucht leictreach ag na neodróin. Má tá líon na bprótón agus na leictreon cothrom, ansin tá an t-adamh neodrach go leictreach. Má tá níos mó nó níos lú leictreon ag adamh ná prótóin, ansin tá lucht diúltach nó dearfach foriomlán aige, faoi seach - tugtar iain ar na hadaimh sin.
Aomann an fórsa leictreamaighnéadach leictreoin an adaimh chuig na prótóin i núicléas adamhach. Aomann an fórsa núicléach na prótóin agus na neodróin sa núicléas chuig a chéile. Is gnách go mbíonn an fórsa seo níos láidre ná an fórsa leictreamaighnéadach a éarann na prótóin atá luchtaithe go dearfach óna chéile. Faoi imthosca áirithe, éiríonn an fórsa leictreamaighnéadach éartha níos láidre ná an fórsa núicléach. Sa chás seo, scoilteann an núicléas agus fágtar dúile éagsúla ina dhiaidh. Is cineál meatha radaighníomhaigh é seo.
Tugtar an uimhir adamhach ar líon na bprótón sa núicléas agus sainmhíníonn sé cén dúil cheimiceach lena mbaineann an t-adamh. Mar shampla, is copar é aon adamh ina bhfuil 29 prótón. Sainmhíníonn líon na neodrón iseatóp na dúile. Is féidir le hadaimh ceangal le adamh amháin nó níos mó le naisc ceimiceacha chun comhdhúile ceimiceacha mar mhóilíní nó criostail a dhéanamh. Tá cumas na n-adamh ceangail agus dícheangail freagrach as an gcuid is mó de na hathruithe fisiciúla a bhreathnaítear sa nádúr. Is í an cheimic an disciplín a dhéanann staidéar ar na hathruithe seo.
Stair na teoirice adamhaí
[cuir in eagar | athraigh foinse]Sa bhfealsúnacht
[cuir in eagar | athraigh foinse]Tá an smaoineamh bunúsach go bhfuil dúile comhdhéanta de cháithníní bídeacha doroinnte an-sean, le feiceáil i go leor cultúir ársa mar an Ghréig agus an India. Díorthaítear an focal adamh ón nGréigis Ársa ἄτομος [átomos], rud a chiallaíonn "aonad do-roinnte". Bhí an smaoineamh seo bunaithe ar réasúnaíocht fhealsúnacht seachas ar réasúnaíocht eolaíoch, agus níl teoiric adamhach na linne seo bunaithe ar na seanchoincheapa seo. Go luath sa 19ú haois, thug an t - eolaí John Dalton faoi deara go gceanglaíonn dúile ceimiceacha lena chéile le haonaid bhunúsacha enchain agus chinn sé an focal "adamh" a úsáid chun tagairt a dhéanamh do na haonaid seo ar an bharúil gurb iad seo cáithníní bunúsacha an ábhair. Timpeall céad bliain ina dhiaidh sin fuarthas amach nach bhfuil adaimh Dalton i ndáiríre doroinnte. É sin ráite, d’úsáid smaointeoirí an focal “adamh” féin ar feadh na n-aoiseanna a raibh amhras orthu go raibh an t-ábhar sin gráinneach sa deireadh.[1][2]
Dlí Dalton na gcomhréir iolrach
[cuir in eagar | athraigh foinse]Go luath sna 1800idí, thiomsaigh poitigéir Sasanach John Dalton sonraí turgnamhacha a bhailigh sé féin agus eolaithe eile agus fuair sé patrún ar a dtugtar "dlí na gcomhréir iolrach" anois. Thug sé faoi deara, i gcomhdhúile ceimiceacha ina bhfuil dúil cheimiceach áirithe, go mbeidh cion na dúile sin sna comhdhúile seo difriúil de réir cóimheasa slánuimhreacha beaga. Thug an patrún seo le tuiscint do Dhalton go gcuingríonn gach dúil cheimiceach le dúile eile le haonad maise bunúsach agus comhsheasmhach.
Mar shampla, tá dhá chineál den ocsaíd stáin ann: púdar dubh atá 88.1% stáin agus 11.9% ocsaigin, agus ceann eile púdar bán atá 78.7% stáin agus 21.3% ocsaigine. Ag coigeartú na bhfigiúirí seo, san ocsaíd dhubh tá thart ar 13.5 g d’ocsaigin in aghaidh gach 100 g de stáin, agus san ocsaíd bhán tá thart ar 27 g d’ocsaigin in aghaidh gach 100 g de stáin. Cruthaíonn 13.5 agus 27 cóimheas 1: 2. Sna hocsaídí seo, i gcás gach adamh stáin tá adamh amháin nó dhó ocsaigine faoi seach (SnO agus SnO2).[3][4]
Mar dhara sampla, mheas Dalton dhá ocsaíd iarainn: púdar dubh atá 78.1% iarann agus 21.9% ocsaigin, agus púdar dearg atá 70.4% iarann agus 29.6% ocsaigin. Ag coigeartú na bhfigiúirí seo, san ocsaíd dhubh tá thart ar 28 g d’ocsaigin in aghaidh gach 100 g d’iarann, agus san ocsaíd dhearg tá thart ar 42 g d’ocsaigin in aghaidh gach 100 g d’iarann. Cruthaíonn 28 agus 42 cóimheas 2:3. Sna hocsaídí faoi seach seo, i gcás gach dhá adamh iarainn, tá dhá nó trí adamh ocsaigine (Mar dhara sampla, mheas Dalton dhá ocsaíd iarainn: púdar dubh atá 78.1% iarann agus 21.9% ocsaigin, agus púdar dearg atá 70.4% iarann agus 29.6% ocsaigin. Ag coigeartú na bhfigiúirí seo, san ocsaíd dhubh tá thart ar 28 g d’ocsaigin in aghaidh gach 100 g d’iarann, agus san ocsaíd dhearg tá thart ar 42 g d’ocsaigin in aghaidh gach 100 g d’iarann. Cruthaíonn 28 agus 42 cóimheas 2: 3. Sna ocsaídí faoi seach seo, i gcás gach dhá adamh iarainn, tá dhá nó trí adamh ocsaigine (Mar dhara sampla, mheas Dalton dhá ocsaíd iarainn: púdar dubh atá 78.1% iarann agus 21.9% ocsaigin, agus púdar dearg atá 70.4% iarann agus 29.6% ocsaigin. Ag coigeartú na bhfigiúirí seo, san ocsaíd dhubh tá thart ar 28 g d’ocsaigin in aghaidh gach 100 g d’iarann, agus san ocsaíd dhearg tá thart ar 42 g d’ocsaigin in aghaidh gach 100 g d’iarann. Cruthaíonn 28 agus 42 cóimheas 2: 3. Sna ocsaídí faoi seach seo, i gcás gach dhá adamh iarainn, tá dhá nó trí adamh ocsaigine (Fe2O2 agus Fe2O3).[5][6]
Mar shampla deiridh: tá 63.3% nítrigin agus 36.7% ocsaigin in ocsaíd nítriúil, 44.05% nítrigin agus 55.95% ocsaigin in ocsaíd nítreach, agus 29.5% nítrigin agus 70.5% ocsaigin i ndé-ocsaíd nítrigine. Agus na figiúirí seo á gcoigeartú, in ocsaíd nítriúil tá 80 g ocsaigine in aghaidh gach 140 g de nítrigin, in ocsaíd nítreach tá thart ar 160 g d'ocsaigin do gach 140 g de nítrigin, agus i ndé-ocsaíd nítrigine tá 320 g d'ocsaigin do gach 140 g de nítrigin. Cruthaíonn 80, 160, agus 320 cóimheas 1: 2: 4. Is iad na foirmlí faoi seach do na hocsaídí seo ná N2O, NO, agus NO2.[7][8]
Teoiric chinéiteach na ngás
[cuir in eagar | athraigh foinse]Ag deireadh an 18ú haois, fuair roinnt eolaithe amach go bhféadfaidís iompar gás a mhíniú níos fearr trí chur síos a dhéanamh orthu mar bhailiúcháin de cháithníní fo-mhicreascópacha agus a n-iompar a shamhaltú ag úsáid staitistice agus dóchúlachta. Murab ionann agus teoiric adamhach Dalton, déanann teoiric chinéiteach na ngás cur síos ní amháin ar an gcaoi a n-imoibríonn gáis go ceimiceach lena chéile chun comhdhúile a dhéanamh, ach conas a n-iompraíonn siad go fisiciúil: idirleathadh, slaodacht, seoltacht, brú, srl.
Brúnghluaisne
[cuir in eagar | athraigh foinse]Sa bhliain 1827, d’úsáid an luibheolaí Robert Brown micreascóp chun breathnú ar ghráin deannaigh ag snámh in uisce agus fuair sé amach go raibh gluaiseacht chorr acu, feiniméan ar a tugadh "brúnghluaisne". Ceapadh gur móilíní uisce ba chúis leis seo agus iad ag bualadh na ngrán. Sa bhliain 1905, chruthaigh Albert Einstein réaltacht na móilíní seo agus a ngluaiseachtaí tríd an gcéad anailís staitistiúil fhisiceach ar bhrúnghluaisne a tháirgeadh.[9] D'úsáid an fisiceoir Francach Jean Perrin [10] obair Einstein chun mais agus toisí móilíní a chinneadh go turgnamhach, agus ar an gcaoi sin fianaise fhisiciúil a sholáthar maidir le nádúr cáithnín an damhna.
Fionnachtain an leictreon
[cuir in eagar | athraigh foinse]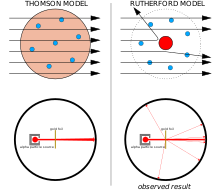
Ar chlé: Torthaí a bhfuil súil leo: cáithníní alfa ag dul trí samhail Thomson den adamh (amhail rísíní i maróg Nollag) le sraonadh fánach.
Ar dheis: Torthaí breathnaithe : sraonadh cuid bheag de na cáithníní le lucht deimhneach comhchruinnithe an núicléis.
Sa bhliain 1897, fuair J. J. Thomson amach nach tonnta leictreamaighnéadacha iad gathanna catóideacha ach go ndéantar iad de cháithníní atá 1,800 uair níos éadroime ná hidrigin (an t-adamh is éadroime). Tháinig Thomson ar an gconclúid gur tháinig na cáithníní seo ó na hadaimh laistigh den chatóid - gur cháithníní fo-adamhacha iad. Ghlaoigh sé corpuscles (Gaeilge: corpáin) ar na gcáithníní nua seo, ach ina dhiaidh sin, athainmníodh iad ina leictreoin. Léirigh Thomson freisin go raibh leictreoin comhionann le cáithníní astaithe as ábhair fhótaileictreach agus radaighníomhacha. Aithníodh go tapa gur leictreoin iad na cáithníní a iompraíonn sruthanna leictreacha i sreanga miotail. Rinne Thomson amach gur eascair na leictreoin seo as na hadaimh ón chatóide ina chuid gléasanna, rud a chiallaigh nach bhfuil adaimh doroinnte mar a thugann an t-ainm atomos le fios.
Fionnachtain an núicléis
[cuir in eagar | athraigh foinse]Shíl J. J. Thomson gur dáileadh na leictreoin a bhí luchtaithe go diúltach ar fud an adaimh i slua mór de lucht deimhneacha a bhí dáilte amach ar fud toirte iomláine an adaimh. Uaireanta tugtar Samhail na Maróige Rísíní (Béarla: plum pudding model) ar an tsamhail seo.
Bhí an-amhras ar Ernest Rutherford agus a chomhghleacaithe Hans Geiger agus Ernest Marsden faoin tsamhail seo áfach, tar éis dóibh deacrachtaí a fháil nuair a rinne siad iarracht ionstraim a thógáil chun an cóimheas lucht-go-mais d'alfa-cháithnín a thomhas (is cáithníní luchtaithe go dearfach iad seo a astaíonn substaintí radaighníomhacha áirithe mar raidiam). Bhí na halfacháithníní á scaipeadh ag an aer sa coimeádán braite, rud a fhágann nach raibh na tomhais iontaofa. Bhí fadhb den chineál céanna ag Thomson ina chuid oibre ar ghathanna catóide, a réitigh sé trí fholús beagnach foirfe a chruthú ina chuid uirlisí.
Fionnachtain na n-iseatóp
[cuir in eagar | athraigh foinse]Agus é ag turgnamh le táirgí an mheatha radaighníomhaigh, sa bhliain 1913 fuair an radaicheimiceoir Frederick Soddy amach gur chosúil go raibh níos mó ná cineál amháin adamh ag gach suíomh ar an tábla peiriadach.[11] Ba é Margaret Todd a chum an téarma iseatóp mar ainm oiriúnach d’adamh éagsúil a bhaineann leis an dúil chéanna. Chruthaigh J. J. Thomson teicníc le haghaidh iseatóp a dheighilt trína chuid oibre ar gháis ianaithe, rud a d’fhág gur aimsíodh iseatóip cobhsaí ina dhiaidh sin.[12]
Samhail Bohr
[cuir in eagar | athraigh foinse]
D’fhonn na fadhbanna a bhain le samhail an adaimh de réir Rutherford a cheartú, sa bhliain 1913 chuir Niels Bohr trí phostaláid chun cinn a dhéanann achoimre ar an gcuid is mó dá theoiric:
Tugtar struchtúr Bohr den adamh ar léaráid d’adamh a thaispeánann an tslí a bhfuil na leictreoin eagraithe. Taispeántar struchtúr Bohr d’adamh hidrigine sa bheochan ar dheis. Is é an t-eagar leictreon don adamh hidrigine ná n=1.
- Teoiric go dtaistlíonn leictreoin i bhfithis scoite timpeall núicléas an adaimh, le gnéithe ceimiceacha den dúil socraithe ag an méid leictreoin atá ag timpeallú an adaimh
- An tuairim go bhféadfadh leictreon titim ó fhithis le leibhéal airde dfhuinneamh go dtí leibhéal níos ísle, ag astaigh fótóin (candam éadrom) le fuinneamh scoite (bhí seo buntús na teoirice candamaí)
- An Prionsabal Comhlántíochta : go bhféadfadh staidéar a dhéanamh ar ábhar ina gceann agus ina gceann ach a aimsiú go bhfuil cúpla gnéithe frithráiteacha.
Samhail Schrödinger
[cuir in eagar | athraigh foinse]Chuir turgnamh Stern-Gerlach sa bhliain 1922 fianaise bhreise ar fáil maidir le nádúr chandamach airíonna adamhacha. Nuair a ritheadh léas d'adamh airgid trí réimse maighnéadach a bhí múnlaithe go speisialta, roinneadh an léis ar bhealach a bhí comhghaolmhar le treo nó guairne mhóiminteam uilleach an adaimh. Toisc go bhfuil an ghuairne seo randamach i dtosach, bheifí ag súil go sraonadh an léis i dtreo randamach. Ina áit sin, roinneadh an léas ina dhá chomhpháirt threorach, a fhreagraíonn don ghuairne adamhaí, é a bheith dírithe suas nó síos maidir leis an réimse maighnéadach.[13]
Sa bhliain 1925 d’fhoilsigh Werner Heisenberg an chéad fhoirmiú matamaiticiúil comhsheasmhach ar mheicnic chandamach (meicnic mhaitríseach). Bliain roimhe sin, mhol Louis de Broglie an hipitéis de Broglie: go n-iompraíonn na cáithníní go léir mar thonnta go pointe áirithe,[14] agus i 1926 d’úsáid Erwin Schrödinger an smaoineamh seo chun cothromóid Schrödinger a fhorbairt, samhail mhatamaiticiúil den adamh (tonnmheicnic) a thuairiscigh na leictreoin mar thonnta tríthoiseacha seachas mar phonc-cháithníní.[15]
Toradh ar úsáid tonnfhoirmeacha chun cur síos a dhéanamh ar cháithníní ná go bhfuil sé dodhéanta go matamaiticiúil luachanna beachta a fháil do shuíomh agus do mhóiminteam cáithnín ag pointe ama áirithe; tugadh prionsabal na neamhchinnteachta air seo, a chuir Werner Heisenberg le chéile i 1927. Sa choincheap seo, chun cruinneas ar leith a fháil maidir le suíomh a thomhas ní fhéadfadh duine ach raon luachanna dóchúla a fháil don mhóiminteam, agus a mhalairt.[16] Bhí an tsamhail seo in ann breathnuithe ar iompar adamhach nach bhféadfadh samhlacha roimhe seo a mhíniú, mar shampla patrúin struchtúracha agus speictrim áirithe adamh a bhí níos mó ná hidrigin. Dá bhrí sin, caitheadh samhail reatha phláinéadach an adaimh i dtraipisí, i bhfabhar ceann a thuairiscigh criosanna d'fhithiseáin adamhacha timpeall an núicléas inar dóchúil go dtabharfaí faoi deara leictreon ar leith.[17][18]
Fionnachtana an neodróin
[cuir in eagar | athraigh foinse]Lig forbairt an mais-speictriméadar mais na n-adamh a thomhas le cruinneas méadaithe. Úsáideann an gléas maighnéad chun conair leas iain a lúbadh, agus déantar méid an tsraonaidh a chinneadh de réir an chóimheas idir mais adamh agus a lucht. D'úsáid an ceimiceoir Francis William Aston an ionstraim seo chun a thaispeáint go raibh maiseanna difriúla ag iseatóip. Athraíodh mais adamhach na n-iseatóp seo de réir méideanna slánuimhir, ar a dtugtar riail na slánuimhreach.[19] Bhí an míniú ar na hiseatóip dhifriúla seo ag fanacht go bhfuarthas an neodrón, cáithnín neamhluchtaithe le mais cosúil leis an bprótón, ag an bhfisiceoir James Chadwick i 1932. Ansin, míníodh iseatóip mar dúile leis an líon céanna prótón, ach le líon difriúil neodrón laistigh den núicléas.[20]
Sa bhliain 1938, threoraigh an ceimiceoir Gearmánach Otto Hahn, mac léinn de chuid Rutherford, neodróin ar adaimh úráiniam ag súil go bhfaigheadh siad dúile trasúránacha. Ina áit sin, léirigh a thurgnaimh go bhfuair sé bairiam mar tháirge.[21][22] Bliain ina dhiaidh sin, d’fhíoraigh Lise Meitner agus a nia Otto Frisch gurbh é toradh Hahn an chéad eamhnú núicléach turgnamhach.[23][24] Sa bhliain 1944, fuair Hahn an Duais Nobel sa Cheimic. In ainneoin iarrachtaí Hahn, níor aithníodh ionchuir Meitner agus Frisch.[25]
Sna 1950idí, lig forbairt luasairí cáithníní cáithníní agus brathadóirí cáithníní d’eolaithe staidéar a dhéanamh ar thionchar adamh ag gluaiseacht ag fuinneamh ard.[26] Fuarthas go raibh neodróin agus prótóin ina hadróin, nó ina gcomhdhúile de cháithníní níos lú ar a dtugtar cuairc. Forbraíodh samhail chaighdeánach fhisic na gcáithníní a mhínigh go dtí seo airíonna an núicléis go dtí seo i dtéarmaí na gcáithníní fo-adamhacha seo agus na bhfórsaí a rialaíonn a n-idirghníomhaíochtaí.[27]
Airíonna
[cuir in eagar | athraigh foinse]Airíonna núicléacha
[cuir in eagar | athraigh foinse]De réir sainmhínithe, baineann aon dá adamh a bhfuil an líon céanna prótón ina núicléis leis an dúil cheimiceach chéanna. Is iseatóip dhifriúla den dúil chéanna iad adaimh a bhfuil an líon céanna prótón iontu ach líon difriúil neodrón. Mar shampla, glacann gach adamh hidrigine prótón amháin isteach go díreach, ach tá iseatóip ann gan aon neodrón (hidrigin-1, an fhoirm is coitianta i bhfad,[28] ar a dtugtar próitiam freisin), neodrón amháin (deoitéiriam), dhá neodrón (tritiam) agus níos mó ná dhá neodrón. Cruthaíonn na dúile aitheanta tacar uimhreacha adamhacha, ón dúil hidrigin le prótón amháin thuas go dtí óganasan,[29] dúil le 118 prótón. Bíonn gach iseatóp de dhúile le le huimhreacha adamhacha níos mó ná 82 radaighníomhach, cé go bhfuil radaighníomhaíocht dúile 83 (biosmat) chomh beag sin go bhfuil sí diomaibhseach go praiticiúil.[30][31]
Tá thart ar 339 núicléicíd le fáil go nádúrtha ar an Domhan, agus níor breathnaíodh go bhfuil 252 (thart ar 74%) ag meath, agus tugtar "iseatóip chobhsaí" orthu. Níl ach 90 núiclíd cobhsaí go teoiriciúil, agus níor breathnaíodh go bhfuil 162 eile (ag tabhairt an t-iomlán go 252) ag meath, cé go teoiriciúil tá sé indéanta go bhfuil sé indéanta go fuinniúil. Aicmítear iad go foirmiúil mar "cobhsaí". Sa bhreis, bíonn leathré níos faide ná 100 milliún bliain ag 34 núiclide radaighníomhach breise, agus tá siad beo le fada an lá le bheith i láthair ó rugadh an grianchóras. Tugtar núicídí príomhordúla ar an mbailiúchán seo de 286 núiclíd. Mar fhocal scoir, is eol go dtarlaíonn 53 núiclíd gearrshaolach breise go nádúrtha, mar iníon-tháirgí de mheathlú núiclíde (mar raidiam ó úráiniam), nó mar tháirgí de phróisis fuinniúla nádúrtha ar an Domhan, mar shampla tuairgneáil gathanna cosmacha (mar shampla, carbón -14).
I gcás 80 de na dúile ceimiceacha, tá iseatóp cobhsaí amháin ar a laghad ann. De ghnáth, níl ach dornán de na hiseatóip cobhsaí do gach ceann de na dúile seo, agus is é an meán ná 3.2 iseatóp cobhsaí in aghaidh na dúile. Níl ach iseatóp cobhsaí amháin ag Fiche sé dúil, agus is é deich an líon is mó iseatóip chobhsaí a breathnaíodh d’aon dhúil, sé sin don dhúil stáin. Níl aon iseatóip chobhsaí ag dúile 43, 61, agus gach dúil dar uimhir 83 nó níos airde.[32]
Bíonn tionchar ag an gcóimheas prótón go neodrón ar chobhsaíocht na n-iseatóp, agus freisin ag láithreacht “uimhreacha draíochta” áirithe de neodróin nó prótóin a léiríonn scealla candamacha dúnta agus líonta. Freagraíonn na scealla candamacha seo do shraith leibhéal fuinnimh laistigh de shamhail an núicléis adamhaigh; Tugann scealla líonta, mar an sceall líonta de 50 prótón i gcás stáin, cobhsaíocht neamhghnách don núiclíd. As na 252 núiclíd chobhsaí ar a dtugtar, níl ach ceithre cinn acu le corr-uimhir prótón agus corr-uimhir neodrón: hidrigin-2 (deoitéiriam), litiam-6, bórón-10 agus nítrigin-14. Chomh maith leis sin, níl ach leathré thar billiún bliain ag ceithre corr-corr núiclíd radaighníomhach a tharlaíonn go nádúrtha : potaisiam-40, vanaidiam-50, tantalam-138 agus tantalum-180m. Tá an chuid is mó de núicléis corr-corr an-éagobhsaí maidir le béite-mheath, toisc go bhfuil na táirgí meatha cothrom- cothrom, agus dá bhrí sin tá siad faoi cheangal níos láidre, mar gheall ar éifeachtaí péireála núicléacha.[33]
Mais
[cuir in eagar | athraigh foinse]Tagann an chuid is mó de mhais adamh ó na prótóin agus na neodróin a bhíonn istigh ann. Tugtar an mhaisuimhir ar líon iomlán na gcáithníní seo (ar a dtugtar "núicléóin") in adamh ar leith. Is slánuimhir dearfach agus éadoiseach (in ionad toise maise maise a bheith aici) í, toisc go gcuireann sí comhaireamh in iúl. Sampla d’úsáid maisuimhreach is ea "carbón-12," ina bhfuil 12 núicléas (sé phrótón agus sé neodrón).
Is minic a chuirtear mais iarbhír an adaimh ar fos in iúl i ndaltúin (Da), ar a dtugtar an t-aonad maise adamhaí aontaithe (u) freisin. Sainmhínítear an t-aonad seo mar an dóú cuid déag de mhais adamh neodrach saor de charbón-12, atá thart ar 1.66 × 10−27 kg.[34] Tá meáchan adamhach 1.007825 Da [35] ag hidrigin-1 (an t-iseatóp is lú hidrigine arb í an núiclíd leis an mais is ísle í freisin. Tugtar an mhais adamhach ar luach na huimhreach seo. Bíonn mais adamhach ag adamh ar leith tuairim is cothrom (laistigh de 1%) lena mhais-uimhir oiread an aonaid mhais adamhach (mar shampla tá mais nítrigine-14 thart ar 14 Da), ach ní slánuimhir í an uimhir seo ach amháin (de réir sainmhínithe) i gcás carbóin-12.[36] Is é an t-adamh cobhsaí is troime na luaidhe-208, le mais 207.9766521 Da.[37]
Toisc go bhfuil fiú na hadaimh is ollmhó i bhfad ró-éadrom le bheith ag obair leo go díreach, úsáideann ceimiceoirí aonad na mól ina ionad. Bíonn an líon céanna adamh i gcónaí ag mól amháin d’aon dúil (thart ar 6.022 × 1023). Roghnaíodh an uimhir seo ionas go mbeidh mais adamhach 1 u ag dúil, beidh mais gar do ghram amháin ag mól d'adamh den dúil sin. Mar heall ar an sainmhíniú ar an aonad maise adamhaí aontaithe, tá mais adamhach de 12 Da ag gach adamh carbóin-12, agus mar sin tá meáchan 0.012 kg ag mól d'adamh carbóin-12.[38]
Cruth agus méid
[cuir in eagar | athraigh foinse]Níl teorainn sheachtrach shainithe ag adamh, mar sin de ghnáth déantar cur síos ar a gcuid toisí i dtéarmaí ga adamhach. Is tomhas é seo ar an bhfad a shíneann scamall na leictreon ón núicléas.[39] Glacann sé leis seo go bhfuil cruth sféarúil ag an adamh, nach ngéilltear dó ach d’adamh i bhfolús nó i saorspás. Is féidir gathanna adamhacha a dhíorthú ó na faid idir dhá núicléas nuair a cheanglaítear an dá adamh i naisc cheimiceacha. Athraíonn an ga de réir shuíomh an adaimh ar an gcairt adamhach, an cineál naisc cheimiceach, líon na n-adamh comharsanachta (uimhir chomhordúcháin) agus airí na meicnic chandamach ar a dtugtar an ghuairne.[40] Ar thábla peiriadach na ndúl, is gnách go méadaíonn méid an adaimh agus nuair a bhogann duine síos na colúin, ach laghdaíonn sé agus duine ag bogadh trasna sraitheanna (clé go deas).[41] Dá bhrí sin, is é héiliam an t-adamh is lú le ga 32 pm, agus is caeisiam ceann de na cinn is mó ag 225 pm.[42] Nuair a chuirtear a leithéid agus réimsí leictreacha faoi fhórsaí seachtracha, féadfaidh cruth adamh imeacht ó shiméadracht sféarúil. Braitheann an dífhoirmiú ar mhéid an réimse agus ar an cineál fithiseáin de na leictreoin san sceall seachtrach, mar a thaispeántar le cúinsí grúptheoiriciúla. D’fhéadfaí diallais asféarúla a fháil, mar shampla, i gcriostail, áit a bhféadfadh réimsí móra criostail-leictreacha tarlú ag láithreáin laitíse siméadrachta íseal. Taispeánadh go bhfuil dífhoirmíochtaí suntasacha éileapsóideach le haghaidh ian sulfair [43] agus iain chailcigin [44] i gcomhdhúile de chineál pirít.
Tá toisí adamhacha na mílte uair níos lú ná tonnfhaid an tsolais (400-700 nm) agus mar sin ní féidir iad a fheiceáil ag baint úsáide as micreascóp optúil, cé gur féidir adamh aonair a fheiceáil ag baint úsáide as leictreonmhicreascóp scanacháin. Chun beagmhéide an adaimh a shamhlú, meas go bhfuil gruaig dhaonna tipiciúil thart ar 1 mhilliún adamh carbóin ar leithead.[45] Tá thart ar 2 seisilliún (2*1022) adamh ocsaigine i mbraon amháin uisce, agus dhá oiread an líon sin d'adaimh hidrigine. [46] I ndiamant le carat amháin, agus mais de (2*10-4) adamh ocsaigine, bíonn thart ar 10 seisilliún (1022) adamh carbóin. Dá ndéanfaí úll a mhéadú go méid an Domhain, bheadh na hadaimh san úll thart ar mhéid an úill bhunaidh.[47]
Meath radaighníomhach
[cuir in eagar | athraigh foinse]
Is é is meath radaighníomhach ann ná ceann de na próisis éagsúla a bhíonn ar siúl i núicléis na n-adamh radaighníomhach le núicléis níos cobhsaí a dhéanamh díobh. Nuair atá an núicléas radaighníomhach ag iompú ina núicléas níos cobhsaí, nó ag glacadh céime i dtreo na cobhsaíochta de réir an mheathshlabhra, astaítear cáithnín nó candam radaíochta de cheann de na cineálacha a bhfuil an radaíocht ianaitheach (an radaíocht radaighníomhach) comhdhéanta astu.
Is iad na cineálacha meatha radaighníomhacha is coitianta ná: [48]
- Alfa-mheath: cuirtear an próiseas seo ar siúl nuair a astaíonn an núicléas cáithnín alfa, ar núicléas héiliam é atá comhdhéanta de dhá phrótón agus dhá neodrón. Dúil nua le huimhir adamhach níos ísle is toradh an astaíocht seo.
- Béite-mheath (agus leictreonghabháil): rialaíonn an t-idirghníomhú lag na próisis seo, agus eascraíonn siad as claochlú neodrón go prótón, nó prótón ina neodrón. Tá astú leictreon agus antaineoidríonó ag gabháil leis an trasdul neodrón go prótón, agus is é astú posatrón agus neoidríonó is cúis le trasdul posatrón go neoidríonó (ach amháin i leictreonghabháil). Tugtar béite-cháithníní ar astaíochtaí leictreon nó positron. Méadaíonn nó laghdaíonn béite-mheath uimhir adamhach an núiclis faoi a haon. Tá leictreonghabháil níos coitianta ná astú posatrón, toisc go dteastaíonn níos lú fuinnimh uaidh. Sa mheath den chineál seo, glacann an núicléas leictreon, seachas posatrón astaithe ón núicléas. Astaítear neodrón sa phróiseas seo fós, agus athraíonn prótón go neodrón.
Gáma-mheath: eascraíonn an próiseas seo as athrú ar leibhéal fuinnimh an núicleis go staid níos ísle, as a dtagann astú radaíochta leictreamaighnéadaí. Is gnách go dtarlaíonn staid flosctha núicléis a mbíonn de thoradh air gáma-astuithe tar éis astaíocht alfa nó cáithnín béite. Dá bhrí sin, is gnách go leanann gáma-mheath alfa-mheath nó béite-mheath.
Móimint mhaighnéadach
[cuir in eagar | athraigh foinse]Airí maighnéad, sruthanna ag rith i gcornaí is cáithníní luchtaithe ag guairneáil, a chinneann an chasmhóimint a fheidhmíonn floscdhlús, B, réimse maighnéadach ar an gcóras. Úsáidtear an tsiombail μ di, a thomhaistear san aonad A m2 (aimpéar·méadar cearnach), agus is ionann an t-aonad seo is J T-1 (giúl in aghaidh teisle). Is cainníocht veicteoireach í seo, a dtugtar móimint dhépholach mhaighnéadach uirthi freisin. Is í an chasmhóimint (torc) Γ = μ B sinθ, nuair is í θ an uillinn idir treo B is treo μ. Bíonn móimint mhaighnéadach ag cáithnín luchtaithe (cosúil le leictreoin is prótóin) atá ag guairneáil, agus iompraíonn sé mar a bheadh corna sruthiompartha ann. Bíonn móimint mhaighnéadach fiú ag neodrón, nach bhfuil lucht glan aige, mar go mbíonn sé comhdhéanta as foluchtanna atá ag guairneáil. Tagann móimintí maighnéadacha neodrón i bhfeidhm i dturgnaimh díraonta neodrón. Ar an dóigh chéanna, bíonn móimintí maighnéadacha ag núicléis adamhacha, agus tagann siad seo i bhfeidhm in athshondas núicléach maighnéadach. Mar an gcéanna, in adaimh áirithe ní chealaíonn móimintí maighnéadacha éagsúla na leictreon, a éiríonn óna gcuid guairní nó gluaisní timpeall an núicléis, a chéile. Mar sin, bíonn móimint mhaighnéadach ghlan ag a leithéid d'adamh, agus is é seo bunús na n-airíonna maighnéadacha ábhar toirtiúil, paramaighnéadas is fearómaighnéadas. I gcás maighnéid a chuirtear i réimse maighnéadach, feidhmíonn fórsa an réimse chun iomláine na bhfomhóimintí uile, agus mar sin, poil an mhaighnéid, a ailíniú i dtreo an réimse. Is mar seo a oibríonn compás. Luainíonn cáithníní luchtaithe atá ag guairneáil taobh istigh den ábhar, agus iad suite i réimse maighnéadach, sa treo chéanna le treo a nguairneála (arb ionann é agus treo a móimintí maighnéadacha). Bíonn an luainíocht seo thart ar threo an réimse sheachtraigh.
Leibhéil fuinnimh
[cuir in eagar | athraigh foinse]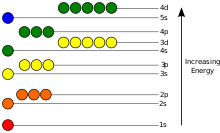
Tá fuinneamh poitéinsiúil leictreoin in adamh diúltach i dtaca leis an uair a théann an fad ón núicléas go héigríoch; sroicheann a spleáchas ar shuíomh an leictreon go íosmhéid taobh istigh den núicléas, a bheag nó a mhór i gcomhréire inbhéartach leis an bhfad. Sa tsamhail chandamach-mheicniúil, ní féidir le leictreon ceangailte ach sraith staideanna atá dírithe ar an núicléas a shealbhú, agus freagraíonn gach staid do leibhéal sonrach fuinnimh; féach cothromóid am-neamhspleách Schrödinger, le haghaidh míniú teoiriciúil. Is féidir leibhéal fuinnimh a thomhas de réir na méide fuinnimh is gá chun an leictreon a neamhcheangal ón adamh, agus tugtar é de ghnáth in aonaid leictreonvoltaí (eV). Tugtar an bhunstaid ar an staid is ísle den leictreon ceangailte, .i. staid chónaitheach, agus bíonn staid fhlosctha mar thoradh ar aistriú leictreon go leibhéal níos airde. Méadaíonn fuinneamh an leictreoin in éineacht le n toisc go méadaíonn meánfhad an núicléis. Ní de bharr phoitéinsil leictreastataigh an núicléis is cúis le spleáchas na candamuimhreach asamataí fuinnimh ar ℓ, ach trí idirghníomhaíocht idir leictreoin.
Ionas gur féidir le leictreon trasnú idir dhá staid éagsúla, .i. bunstaid go dtí an chéad staid fhlosctha, caithfidh sé fótón a ionsú nó a astú ag fuinneamh a mheaitseálann an difríocht i bhfuinneamh poitéinsiúil na leibhéal sin, de réir samhla Niels Bohr, gur féidir a ríomh go beacht le cothromóid Schrödinger. Léimeann leictreoin idir fithiseáin ar bhealach cosúil le cáithníní. Mar shampla, má bhuaileann fótón amháin na leictreoin, ní athraíonn ach leictreon amháin as an bhfitis ina bhfuil sé mar fhreagairt ar an bhfótón; féach airíonna leictreon.
Tá fuinneamh fótóin astaithe comhréireach lena mhinicíocht, agus mar sin feictear na leibhéil shonracha fuinnimh seo mar bhandaí ar leith sa speictream leictreamaighnéadach.[49] Tá speictream saintréitheach ag gach dúil ag brath ar a lucht núicléach, na foscealla líonta le leictreoin, na hidirghníomhaíochtaí leictreamaighnéadacha idir na leictreoin agus fachtóirí eile.[50]

Nuair a théann speictream leanúnach fuinnimh trí ghás nó plasma, d'fhéadadh lectreon i bhfithis ar leith cuid den fhuinneamh sin a ionsú agus imeacht as an bhfithis ina bhfuil sé go dtí fithis ina bhfuil leibhéal fuinnimh níos airde. Deirtear go bhfuil an leictreon i riocht flosctha ansin. Tamall an-ghearr ina dhiaidh sin, titeann an leibhéal fuinnimh sa leictreón, fileann se ar a bhunleibhéal fuinnimh agus tigann sé amach méid fuinnimh atá cothrom leis an difríocht idir an dá leibhéal. Bíonn dath ae leith ag solas de mhiníocht ar leith agus feictear mar líne é ma spréitear le priosma nó le gríl díraona é.
Ós rud é go bhfuil fithisí ar leith san adamh ar féidir le leictreon aistrriú eatarthu, astaítear minicíochtaí ar leith agus cruthaítear línte se dhathanna cinnte ar leith, de réir sin. Bíonn líon difriúil leictreon i bhfithísí difriúla in adaimh dhifriúla. Astaíonn gach adamh sraith ar leith minicíochtaí dá réir sin .i. bíonn línte speictreacha sainiúil ar leith ag gach ceann se na dúile difriúla. Ligeann tomhais speictreascópacha ar neart agus leithead na línte speictreacha adamhacha comhdhéanamh agus airíonna fisiceacha substainte a chinneadh.[51] Nochtann grinnscrúdú ar na línte speictrim go bhfuil scoilteanna sa mhínstruchtúr ag cuid acu. Tarlaíonn sé seo mar gheall ar chúpláil leictreonghuairne, ar idirghníomhaíocht í idir guairne agus gluaisne an leictreon is forimeallaí.[52] Nuair a bhíonn adamh i réimse maighnéadach seachtrach, roinntear línte speictrim ina dtrí chomhpháirt nó níos mó; feiniméan ar a dtugtar an iarmhairt Zeeman. Is é is cúis leis seo ná idirghníomhú an réimse mhaighnéadaigh le móimint mhaighnéadach an adaimh agus na leictreoi a ngabhann leis. Is féidir le réimse leictreach seachtrach a bheith ina chúis inchomparáide le scoilteadh agus aistriú línte speictrim, trí leibhéil fuinnimh leictreon a mhodhnú, feiniméan ar a dtugtar iarmhairt Stark.[53] Má tá leictreon ceangailte i riocht flosctha, is féidir le fótón a hidirghníomhaíonn leis an bhfuinneamh ceart astú spreagtha fótóin a bhfuil leibhéal fuinnimh meaitseála aige. Chun go dtarlóidh sé seo, caithfidh an leictreon titim go staid fuinnimh níos ísle a bhfuil difríocht fuinnimh aige a mheaitseálann fuinneamh an fhótóin idirghníomhaigh. Bogann an fótón astaithe agus an fótón idirghníomhach as go comhthreomhar agus le pasanna meaitseála. Is é sin, déantar patrúin tonnta an dá fhótón a shioncronú. Úsáidtear an t-airí fisiceach seo chun léasair a dhéanamh, ar féidir leo léas comhleanúnach d'fhuinneanh solais a astú i mbanda minicíochta cúng.[54]
Fiús agus iompar nasctha
[cuir in eagar | athraigh foinse]Is éard is fiús ann ná an oiread nasc ceimiceach is féidir le hadamh amháin a dhéanamh le hadaimh nó móilíní eile.[55] Tomhas is ea é ar chumas nasctha adaimh nó dúile. Tugtar an fiús-sceall ar an leictreonsceall is seachtraí d'adamh ina staid neamhcheangailte, agus tugtar fiúsleictreoin ar na leictreoin sa sceall sin. Cinneann líon na bhfiúsleictreon an iompraíocht nasctha le hadaimh eile. Is iondúil go n-imoibríonn adaimh lena chéile ar bhealach a líonann (nó a fholmhaíonn) a gcuid fiús-sceall seachtrach.[56] Taispeánann go leor dúl fiúsanna iolracha, nó claonadh chun líon éagsúil leictreon a roinnt i gcomhdhúile éagsúla. Dá bhrí sin, bíonn nascáil cheimiceach idir na dúile seo i go leor cineálacha comhroinnte leictreon atá níos mó ná aistriú leictreon simplí. I measc na samplaí tá an dúil carbón agus na comhdhúile orgánacha.[57]
Is minic a thaispeántar na dúile ceimiceacha i dtábla peiriadach a leagtar amach chun airíonna ceimiceacha athfhillteacha a thaispeáint, agus cruthaíonn na dúile a bhfuil an líon céanna fiúsleictreon iontu grúpa atá ailínithe sa cholún céanna den tábla. (Freagraíonn na sraitheanna cothrománacha do sceall candamach leictreon a líonadh.) Tá a sceall seachtrach líonta go hiomlán le leictreoin ag na dúile ar thaobh na láimhe deise den tábla, agus tugtar triathgháis orthu mar thoradh.[58][59]
Staideanna
[cuir in eagar | athraigh foinse]
Faightear go leor adamh i staideanna éagsúla damhnaí atá ag brath ar na dálaí fisiciúla, amhail teocht agus brú. Trí na dálaí a athrú, agus ina sholad, ina leacht, ina ghás nó ina phlasma, sin na ceither sraid dhifriúla ina mbíonn damhna ar fáil.[60] Laistigh den staid, is féidir damhna a bheith ann in allotróip éagsúla. Sampla de seo is ea carbón soladach, ar féidir leis a bheith ann mar ghraifít nó mar dhiamant. Tá allotróip ghásacha ann freisin, mar shampla dé-ocsaigin agus ózón.
Ag teochtaí gar don dearbhnialas, is féidir le hadaimh comhdhlúthán Bose-Einstein a chruthú, agus ag an bpointe sin bíonn éifeachtaí meicniúla chandamach le feiceáil ar scála macrascópach,[61][62] nach mbreathnaítear de ghnáth ach ar an scála adamhach. Ansin iompraíonn an bailiúchán adamh sárfhuaraithe seo mar sháradamh amháin, rud a d’fhéadfadh seiceálacha bunúsacha a dhéanamh ar iompar meicniúil chandamach.[63]
Sainaithint
[cuir in eagar | athraigh foinse]
Cé go bhfuil adaimh róbheag le feiceáil, cuireann gléasanna mar an tollánmhicreascóp scanacháin(TMS) ar chumas iad a léirshamhlú ar dhromchlaí solad. Úsáideann an micreascóp feiniméan an tollánaithe chandamaigh, a ligeann do cháithníní dul trí bhacainn a bheadh dosháraithe sa pheirspictíocht chlasaiceach. Gearrann na leictreoin tollán tríd an bhfolús idir dhá leictreoid claonta, ag soláthar srutha tollánaithe atá ag brath go heaspónantúil ar a scaradh. Is rinn ghéar é leictreoid amháin a chríochnaíonn go hidéalach le hadamh amháin. Ag gach pointe de scanadh an dromchla coigeartaítear airde na rinne chun an tsrutha a choinneáil ag luach socraithe. Léirmhínítear an méid a ghluaiseann an rinn chuig an dromchla agus uaidh mar an próifíl airde. I gcomhair laofachta ísle, déanann an micreascóp íomhá de na fithiseáin leictreon mheánaithe thar leibhéil fuinnimh atá pacáilte go dlúth - staid-dlúis áitiúil gar do leibhéal Fermi.[64][65] Mar gheall ar na faid atá i gceist, caithfidh an dá leictreoid a bheith thar a bheith cobhsaí; ní féidir ach peiriadachtaí a thabhairt faoi deara a fhreagraíonn d'adamh aonair. Níl an modh leis féin sonrach go ceimiceach, agus ní féidir leis na speicis adamhacha atá ar an dromchla a aithint.
Is féidir adaimh a aithint go héasca de réir a maise. Má dhéantar adamh a ianú trí cheann dá leictreon a bhaint, lúbfaidh a ruthag nuair a théann sé trí réimse maighnéadach. Cinneann mais an adaimh an ga trína ndéantar ruthag an iain mhaighnéadaigh a iompú ag an réimse maighnéadach a iompú. Úsáideann an mais-speictriméadar an prionsabal seo chun cóimheas maise-le-lucht na n-ian a thomhas. Má tá iseatóip iomadúla i sampla, is féidir leis an mais-speictriméadar cion gach iseatóp sa sampla a chinneadh trí dhéine na bíomaí éagsúla ian a thomhas. I measc na dteicnící chun adamh a ghalú tá speictreascópacht astaíochta adamhach plasma (Béarla:Inductively coupled plasma atomic emission spectroscopy) agus teascóg mhaighnéadeach cúpláilte go hionduchtach (Béarla: inductively coupled plasma mass spectrometry), an dá cheann acu a úsáideann plasma chun samplaí a ghalú le haghaidh anailíse.[66]
Néal leictreon
[cuir in eagar | athraigh foinse]Naisc sheachtracha
[cuir in eagar | athraigh foinse]- Físeáin Eolaíochta - Struchtúr an Adaimh. https://www.cogg.ie/aiseanna-iar-bhunscoile/fiseain-eolaiochta/ Curtha i gcartlann 2021-04-18 ar an Wayback Machine
Tagairtí
[cuir in eagar | athraigh foinse]- ↑ "The Atom in the History of Human Thought" (1998): 31–33. Oxford, England: Oxford University Press.
- ↑ Melsen (1952). From Atomos to Atom, pp. 18-19
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ↑ Melsen (1952). From Atomos to Atom, p. 137
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, pp. 28
- ↑ Millington (1906). John Dalton, p. 113
- ↑ Dalton (1808). Córas Nua Fealsúnachta Ceimicí vol. 1, lgh. 316-319
- ↑ Holbrow et al (2010). Fisic Réamhrá Nua-Aimseartha , lgh. 65-66
- ↑ Brownian Motion: Fluctuations, Dynamics, and Applications.https://archive.org/details/brownianmotion00mazo
- ↑ Jean Perrin and the triumph of the atomic doctrine https://www.sciencedirect.com/science/article/abs/pii/S0160932707000294?via%3Dihub
- ↑ Frederick Soddy, The Nobel Prize for Chemistry 1921.https://www.nobelprize.org/prizes/chemistry/1921/soddy/biographical/
- ↑ Thomson, Joseph John (1913). "Rays of positive electricity". Proceedings of the Royal Society.A 89, 1-20 (1913)
- ↑ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics. 17 (6): 575–583
- ↑ Introducing Quantum Theory, McEvoy, J. P. et Zarate, Oscar. Totem Books. Lth.110–114
- ↑ "The Schrödinger equation A History" (2019).
- ↑ "What is the Heisenberg Uncertainty Principle?".
- ↑ Brown, Kevin (2007). "The Hydrogen Atom"
- ↑ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto
- ↑ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine. 39 (6): 449–455.
- ↑ Chadwick, James (12 December 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation
- ↑ Bowden, Mary Ellen (1997). "Otto Hahn, Lise Meitner, and Fritz Strassmann". Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. pp. 76–80, 125.
- ↑ "Otto Hahn, Lise Meitner, and Fritz Strassmann". Science History Institute. June 2016.
- ↑ Meitner, Lise; Frisch, Otto Robert (1939). "Disintegration of uranium by neutrons: a new type of nuclear reaction". Nature. 143 (3615): 239–240
- ↑ Schroeder, M. "Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages"
- ↑ Kullander, Sven (28 August 2001). "Accelerators and Nobel Laureates". Nobel Foundation
- ↑ Kullander, Sven (28 August 2001). "Accelerators and Nobel Laureates". Nobel Foundation.
- ↑ "The Nobel Prize in Physics 1990". Nobel Foundation.
- ↑ Matis, Howard S. (9 August 2000). "The Isotopes of Hydrogen". Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab.
- ↑ Weiss, Rick (17 October 2006). "Scientists Announce Creation of Atomic Element, the Heaviest Yet"
- ↑ Sills, Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. pp. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
- ↑ Dumé, Belle (23 April 2003). "Bismuth breaks half-life record for alpha decay". Physics World. Archived
- ↑ CRC Handbook (2002).
- ↑ Krane, K. (1988). Introductory Nuclear Physics. John Wiley & Sons. pp. 68. ISBN 978-0-471-85914-7.
- ↑ Mills, Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2nd ed.). Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. p. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
- ↑ Chieh, Chung (22 January 2001). "Nuclide Stability"
- ↑ "Atomic Weights and Isotopic Compositions for All Elements". National Institute of Standards and Technology.
- ↑ Audi, G.; Wapstra, A.H.; Thibault, C. (2003). "The Ame2003 atomic mass evaluation (II)" (PDF). Nuclear Physics A. 729 (1): 337–676. Bibcode:2003NuPhA.729..337A. doi:10.1016/j.nuclphysa.2003.11.003
- ↑ Mills, Ian (1993). "Quantities, Units and Symbols in Physical Chemistry". Oxford: International Union of Pure and Applied Chemistry, Commission on Physiochemical Symbols Terminology and Units, Blackwell Scientific Publications. OCLC 27011505.
- ↑ Ghosh, D.C. (2002). "Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii". Int. J. Mol. Sci. 3 (11): 87–113. doi:.
- ↑ Shannon, R.D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides" (PDF). Acta Crystallographica A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551
- ↑ Dong, Judy (1998). "Diameter of an Atom". The Physics Factbook. Archived
- ↑ Zumdahl, Steven S. (2002). Introductory Chemistry: A Foundation (5th ed.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482
- ↑ Birkholz, M. (2008). "Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions]". Physica Status Solidi B 245 (9): 1858–1864. doi:. Bibcode: 2008PSSBR.245.1858B.
- ↑ Birkholz, M. (2014). "Modeling the Shape of Ions in Pyrite-Type Crystals". Crystals. 4 (3): 390–403. doi:10.3390/cryst4030390
- ↑ Staff (2007). "Small Miracles: Harnessing nanotechnology". Oregon State University.
- ↑ Padilla, Michael J. (2002). "Prentice Hall Science Explorer: Chemical Building Blocks". Upper Saddle River, New Jersey: Prentice-Hall, Inc.. OCLC 47925884. “There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen.”
- ↑ Feynman, Richard (1995). "Six Easy Pieces". The Penguin Group. OCLC 40499574.
- ↑ L'Annunziata, Michael F. (2003). "Handbook of Radioactivity Analysis": 3–56. Academic Press. OCLC 16212955.
- ↑ Fowles, Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. pp. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711
- ↑ Martin, W.C.; Wiese, W.L. (May 2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology.
- ↑ "Atomic Emission Spectra – Origin of Spectral Lines". Avogadro Web Site. Archived from the original
- ↑ Fitzpatrick, Richard (16 February 2007). "Fine structure".http://farside.ph.utexas.edu/teaching/qm/lectures/node55.html
- ↑ Beyer, H.F.; Shevelko, V.P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. pp. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433
- ↑ Watkins, Thayer. "Coherence in Stimulated Emission". San José State University. Archived
- ↑ IUPAC, Compendium of Chemical Terminology https://goldbook.iupac.org/terms/view/V06588
- ↑ Reusch, William (16 July 2007). "Virtual Textbook of Organic Chemistry". Michigan State University.
- ↑ "Covalent bonding – Single bonds". chemguide. 2000.
- ↑ Husted, Robert; et al. (11 December 2003). "Periodic Table of the Elements". Los Alamos National Laboratory.
- ↑ Baum, Rudy (2003). "It's Elemental: The Periodic Table
- ↑ Goodstein, David L. (2002). "States of Matter": 436–438. Courier Dover Publications.
- ↑ Myers, Richard (2003). The Basics of Chemistry. Greenwood Press. p. 85. ISBN 978-0-313-31664-7. OCLC 50164580
- ↑ Staff (9 October 2001). "Bose–Einstein Condensate: A New Form of Matter". National Institute of Standards and Technology.
- ↑ Colton, Imogen; Fyffe, Jeanette (3 February 1999). "Super Atoms from Bose–Einstein Condensation". The University of Melbourne
- ↑ "The Nobel Prize in Physics 1986". The Nobel Foundation.
- ↑ Jacox, Marilyn; Gadzuk, J. William (November 1997). "Scanning Tunneling Microscope". National Institute of Standards and Technology.
- ↑ Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (1998). "Sector field mass spectrometers in ICP-MS". Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–1763. Bibcode:1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5
| Is síol é an t-alt seo. Cuir leis, chun cuidiú leis an Vicipéid. Má tá alt níos forbartha le fáil i dteanga eile, is féidir leat aistriúchán Gaeilge a dhéanamh. |
