Nasc ceimiceach

Is aomadh buan é nasc ceimiceach idir adaimh, iain nó móilíní a chuireann ar chumas déanmhaíochta comhdhúile ceimiceacha. D’fhéadfadh an nasc teacht as an bhfórsa leictreastatach idir iain atá luchtaithe go hurchomhaireach, amhail i naisc ianacha nó trí chomhroinnt leictreon mar atá i naisc chomhfhiúsacha. Athraíonn neart na nasc ceimiceach go mór; tá “naisc láidre” nó “naisc phríomhúla” mar naisc chomhfhiúsacha, ianacha agus mhiotalacha, agus “naisc laga” nó “naisc thánaisteacha” mar idirghníomhaíochtaí dépholach-dépholach, fórsa scaipthe Londain agus nascadh hidrigine.
San adamh, timpeallaíonn na leictreoin an núicléas i bhfithiseáin i scealla timpeall an núicléis. Muna mbíonn an sceall seachtrach lán le leictreoin, an uasmhéid atá ceadaithe don adamh sin, bíonn an t-adamh éagobhsaí agus fonn air nasc a dhéanamh le hadamh eile. Aithnítear trí shaghas naisc phríomhúil. An nasc ianach, mar atá i gclóiríd sóidiam, NaCl (salann mín), inar chaill an sóidiam leictreon agus ar ghnóthaigh an clóirín leictreon, ionas go gcoinnítear na hiain seo le chéile trí aomadh frithpháirteach idir Na+ is Cl-. Sa nasc comhfhiúsach, mar atá i gclóirín, Cl2, bíonn cuid de na leictreoin bainteach leis an dá núicléas. Nuair a nascann dhá adamh hidrigine (H) le hadamh amháin ocsaigine (O), cruthaítear móilín uisce, H2O, agus bíonn dhá nasc chomhfhiúsacha ann. Sa nasc miotalach, mar atá i sóidiam, Na, bíonn na fiúsleictreoin dílogánaithe agus bainteach le cuid mhaith núicléas, rud a thugann seoltacht leictreach don mhiotal. Tugtar nasc singil ar nasc comhfhiúsach ina bhfuil dhá leictreon i gceist, nasc dúbailte ar cheann le 4 leictreon, agus nasc triarach ar cheann le 6 leictreon. Comharthaítear na naisc seo i bhfoirmlí ceimiceacha le -, =, is ≡. Tugtar an nascfhuinneamh ar an bhfuinneamh is gá chun nasc ceimiceach a bhriseadh (mar shampla, chun móilín clóirín, Cl2, a athrú in dhá adamh clóirín, 2 Cl).

Forbhreathnú ar phríomhchineálacha nasc ceimiceach[cuir in eagar | athraigh foinse]
Is aomadh idir adamh é nasc ceimiceach. Is féidir an t-aomadh seo a mheas mar thoradh ar iompraíochtaí difriúla na leictreon is forimeallaí nó na bhfiúsleictreon den adamh. Comhcheanglaíonn na hiompraíochtaí seo lena chéile gan uaim i gcúinsí éagsúla, ionas gur deacair idirdhealú a dhéanamh eatarthu. Mar sin féin, tá sé úsáideach agus is gnách idirdhealú a dhéanamh idir cineálacha éagsúla nasc, as a dtagann airíonna difriúla damhnaí comhdhlúite.
San dearcadh is simplí ar nasc comhfhiúsach, tarraingítear leictreon amháin nó níos mó (péire leictreon go minic) isteach sa spás idir an dá núicléas adamhach. Scaoiltear fuinneamh trí déanmhaíochta naisc. Níl sé seo mar thoradh ar laghdú ar fhuinneamh poitéinsiúil, toisc go ndéantar aomadh an dá leictreon chuig an dá phrótón a chealú leis na frithghníomhartha leictreon-leictreon agus prótón-prótón. Ina áit sin, eascraíonn an scaoileadh fuinnimh (agus mar sin cobhsaíocht an naisc) ón laghdú ar fhuinneamh cinéiteach toisc go bhfuil na leictreoin i bhfithiseán atá níos scaipthe ó thaobh spáis de (ie tonnta níos faide de Broglie) i gcomparáid le gach leictreon a bheith gaibhnithe níos gaire dá núicléas faoi seach.[1] Tá na naisc seo ann idir dhá adamh inaitheanta áirithe agus tá treo acu sa spás, rud a fhágann gur féidir iad a thaispeáint mar línte ceangailte aonair idir adamh i líníochtaí, nó iad a shamhaltú mar mhaidí idir sféir i múnlaí.
I nasc comhfhiúsach polarach, roinntear leictreon amháin nó níos mó go héagothrom idir dhá núicléas. Is minic go mbíonn bailiúcháin bheaga d’adamh le nasc níos fearr ar a dtugtar móilíní, mar thoradh ar naisc chomhfiúsacha, I solaid agus i leachtanna bíonn siad ceangailte le móilíní eile ag fórsaí atá go minic i bhfad níos laige ná na naisc chomhfhiúsacha a choinníonn na móilíní go hinmheánach le chéile. Tugann naisc idirmhóilíneacha laga den sórt sin substaintí móilíneacha orgánacha, mar shampla céaracha agus olaí, lena mbulc-charachtar , agus a leáphointí ísle (i leachtanna, ní mór do mhóilíní deireadh a chur leis an teagmháil struchtúrtha nó dhírithe lena chéile). Mar sin féin, nuair a nascann naisc chomhfhiúsacha slabhraí fada adamh i móilíní móra, (mar atá i bpolaiméirí mar níolón), nó nuair a shíneann naosc chomhfhiúsacha i líonraí trí sholaid nach bhfuil comhdhéanta de mhóilíní scoite (amhail diamant nó grianchloch nó na mianraí sileacáite i go leor cineálacha carraige) ansin d’fhéadfadh na struchtúir a thig astu a bheith láidir agus diana, ar a laghad sa treo atá dírithe i gceart le líonraí de naisc chomhfhiúsacha. Chomh maith leis sin, méadaíonn leáphointí na bpolaiméirí agus líonraí comhfhiúsacha den sórt sin go mór.
I bhfianaise simplithe ar naisc ianacha, ní roinntear an leictreon nascach ar chor ar bith, ach aistrítear é. Sa chineál seo naisc, tá folúntas ag fithiseach adamhach seachtrach adamh amháin a cheadaíonn leictreon amháin nó níos mó a chur leis. D’fhéadfadh go mbeadh staid fuinnimh níos ísle ag na leictreoin nua sa bhreis seo (níos gaire i ndáiríre do lucht núicléach níos mó) ná mar a bhíonn acu in adamh difriúil. Mar sin, tairgeann núicléas amháin suíomh atá ceangailte níos doichte don leictreon ná do núicléas eile, agus mar thoradh air sin, féadfaidh adamh amháin leictreon a aistriú go dtí an ceann eile. Is cúis leis an aistriú seo go nglacann adamh amháin glanlucht dearfach, agus go nglacann an ceann eile glanlucht diúltach. Ansin bíonn an nasc mar thoradh ar aomadh leictreastatach idir na hiain dearfacha agus hiain luchtaithe go diúltach. Is féidir breathnú ar naisc ianacha mar shamplaí foircneacha de pholarú i naisc chomhfhiúsacha. Go minic, ní bhíonn aon treoshuíomh ar leith ag naisc den sórt sin sa spás, ós rud é go dtagann siad ó aomadh leictreastatach comhionann de gach ian chuig na hiain go léir timpeall orthu. Bíonn naisc ianacha láidir (agus dá bhrí sin teastaíonn teochtaí arda chun substaintí ianacha a leá) ach bíonn siad briosc freisin, ós rud é go bhfuil na fórsaí gearr-raoin idir iain, agus ní scoilteanna siad agus ní thrasnaíonn siad scoilteanna agus bristeacha go héasca. Eascraíonn tréithe fisiciúla de chriostail salainn mianraí clasaiceach, mar shampla salann boird, as an nasc seo.
Cineál nascadh nach luaitear chomh minic is ea nascadh miotalach. Sa chineál seo nasctha, tugann gach adamh i miotal leictreon amháin nó níos mó do “líon” leictreon a chónaíonn idir go leor adamh miotail. San líon seo, tá gach leictreon saor (de bhua nádúr a dtonnta) le bheith bainteach le go leor adamh ag an am céanna. Tarlaíonn an nasc toisc go néiríonn na hadaimh mhiotalacha beagáinín luchtaithe go dearfach, mar gheall ar chailliúint a leictreon, nuair a fhanann na leictreoin aomtha chuig go leor adamh, gan a bheith mar chuid d'aon adamh ar leith. Is féidir breathnú ar nascadh miotalach mar eiseamláir amach is amach de leictreon a dílogánú thar chóras mór leictreon thar chóras mór nasc comhfhiúsach, ina mbíonn gach adamh rannpháirteach. Is minic a bhíonn an cineál nasctha seo an-láidir (bíonn neart teanntachta miotail mar thoradh air). Mar sin féin, tá nascadh miotalach níos comhchoiteann ó thaobh nádúir ná cineálacha eile, agus mar sin tugann siad deis do chriostail mhiotail dífhoirmiú níos éasca, toisc go bhfuil siad comhdhéanta d’adamh a aomann a chéile, ach nach bhfuil dírithe ar aon bhealach ar leith. Mar thoradh air seo bíonn intuargainteacht mhiotal. I Is é an scamall leictreon is cúis le seoltacht leictreach agus theirmeach miotail go maith go tréith, agus a luster lonrach a léiríonn an chuid is mó de mhinicíochtaí solais bháin. i nascadh miotalach, is é an néal leictreon is cúis le seoltacht leictreach agus theirmeach miotail go maith go tréith, agus a luster lonrach a léiríonn an chuid is mó de mhinicíochtaí solais bháin. nascadh miotalach is cúis le deasheoltacht leictreach agus seoltacht theirmeach na miotal, agus a loinnir ghil freisin, a frithchaitheann an chuid is mó de mhinicíochtaí an tsolais ghil.
Stair[cuir in eagar | athraigh foinse]

Chomh luath leis an 12ú haois, bhí go leor buillí faoi thuairim faoi nádúr an naisc cheimicigh, agus ceapadh go raibh cineál leictreonfhiníochta bainteach le cineálacha áirithe speiceas ceimiceach. Sa bhliain 1704, thug Sir Isaac Newton a bhreac-chuntas clúiteach ar a theoiric nasctha adamhaigh, i “"Query 31"” dá Opticks, trína nascann adaimh lena chéile le “fórsa” éigin. Go sonrach, tar éis dó na teoiricí éagsúla a raibh tóir orthu ag an am a athaint, faoin gcaoi gur ceapadh gur cheangal adaimh lena chéile, .i. "adaimh chrúcacha", " glued together by rest", nó "stuck together by conspiring motions", Deir Newton go b’fhearr leis a thuiscint óna gcomhghreamú, an méid seo a leanas; "particles attract one another by some force, which in immediate contact is exceedingly strong, at small distances performs the chemical operations, and reaches not far from the particles with any sensible effect.
Sa bhliain 1819, ar shála aireagán an chairn voltaigh, d’fhorbair Jöns Jakob Berzelius teoiric maidir le cuingir cheimiceach ag cur béime ar charachtair leictridhiúltacha agus leictridheimhneacha na n-adamh cuingreach. Faoi lár an 19ú haois, ag tógáil ar theoiric na bhfréamhacha, teoiric an fhiúis, ar a tugadh "combining power" sa Bhéarla ar dtús, d’fhorbair Edward Frankland, F.A. Kekulé, A.S. Couper, Alexander Butlerov, agus Hermann Kolbe, teoiric an fhiúis, ar a tugadh “cumhacht chomhcheangailte” ar dtús, inar cuireadh comhdhúile le chéile mar gheall ar aomadh na bpol dearfach agus diúltach. Sa bhliain 1904, mhol Richard Abegg a riail gur minic a bhíonn an difríocht idir úasfhiúsanna agus íostfhiúsanna dúile a hocht. Le linn na tréimhse seo, bhí fiús fós ina uimhir eimpíreach bunaithe ar airíonna ceimiceacha amháin.
Tháinig nádúr an adaimh níos soiléire, áfach, nuair a d'aimsigh Ernest Rutherford i 1911 núicléas adamhach timpeallaithe ag leictreoin, agus samhail Niels Bohr i 1913 d'fhithisí leictreon. Thug sé seo le tuiscint go gcinneann leictreoin iompar ceimiceach. Sa bhliain 1916, d’fhorbair an poitigéir Gilbert N. Lewis coincheap na leictreondíse, inar féidir le dhá adamh leictreoin amháin go sé a roinnt, agus ar an gcaoi sin an nasc leictreon aonair, nasc singil, nasc dúbailte, nó triarach a chruthú; i bhfocail Lewis féin, "An electron may form a part of the shell of two different atoms and cannot be said to belong to either one exclusively." (Gaeilge: "Féadfaidh leictreon a bheith ina chuid de sceall dhá adamh éagsúil agus ní féidir a rá go mbaineann sé le ceachtar amháin go heisiach.")[2]
Sa bhliain 1916 freisin, chuir Walther Kossel teoiric chun cinn cosúil leis an tsamhail a bhí ag Lewis, ach amháin gur ghlac samhail Kossel go raibh aistrithe iomlána leictreon idir adamh, agus mar sin de nascadh ianach í. Rinne Lewis agus Kossel araon a gcuid samhlacha nasctha a struchtúrú de réir riail Abegg (1904).
Mhol Niels Bohr samhail den nasc ceimiceach sa bhliain 1913. De réir a shamhail do mhóilín dé-adamhach, cruthaíonn leictreoin adamh an mhóilín fáinne rothlach a bhfuil a phlána ingearach le hais an mhóilín agus ar comhfhad ó na núicléis adamhacha. Baintear cothromaíocht dhinimiciúil an chórais mhóilíneach amach trí chothromaíocht na bhfórsaí idir fórsaí aomtha na núicléas go plána fháinne na leictreon agus fórsaí éartha na núicléas. Chuir an t-samhail Bohr den nasc ceimiceach san áireamh éaradh Coulomb - tá na leictreoin sa bhfáinne ag an bhfad is faide óna chéile.[3][4]
Sa bhliain 1927, dhíorthaigh fisiceoir Danmhargach Øyvind Burrau[5] an chéad tuairisc chandamach iomlán matamaiticiúil ar nasc ceimiceach simplí, .i. an ceann a dtáirgtear le leictreon amháin san ian móilíneach hidrigine, H2+. Léirigh an obair seo go bhféadfadh an cur chuige chandamach i leith nasc ceimiceach a bheith ceart go bunúsach agus ó thaobh na cainníochta de, ach ní fhéadfaí na modhanna matamaitice a úsáidtear a leathnú chuig móilíní a bhfuil níos mó ná leictreon amháin iontu. Chuir Walter Heitler agus Fritz London cur chuige níos praiticiúla, cé nach raibh sé chomh cainníochtúil, chun tosaigh sa bhliain chéanna. Is é an modh Heitler-London bunús teoiric an fhiúsnaisc. I 1929, thug Sir John Lennard-Jones an garmheastachán ar a dtugtar cuingir líneach d' fhithiseáin adamhacha (CLFA) isteach, a mhol freisin modhanna chun struchtúir leictreonacha de mhóilíní F2 (fluairín) agus O2 (ocsaigin) a dhíorthú, ó bhunphrionsabail chandamach.
Léirigh teoiric na bhfithiseán móilíneach seo nasc comhfhiúsach mar fhithiseán a cruthaíodh trí na fithiseáin adamhacha meicniúla chandamach Schrödinger, a bhí tuairimithe do leictreoin in adamh aonair. Ní fhéadfaí na cothromóidí le haghaidh leictreon nascach in adamh il-leictreoin a réiteach chun foirfeachta matamaitice (.i., go hanailíseach), ach thug garmheastacháin dóibh go leor tuartha agus torthaí cáilíochtúla maithe fós. Úsáideann an chuid is mó de na ríomhanna cainníochtúla sa cheimic chandamach na linne seo fiúsnaisc nó teoiric na bhfithiseán móilíneach mar túsphointe, cé go bhfuil an tríú cur chuige, teoiric na feidhme dlúis, ag éirí níos coitianta le blianta beaga anuas.
Sa bhliain 1933, rinne HH James agus AS Coolidge áireamh ar an mhóilín dé-hidrigin, murab ionann agus gach áireamh roimhe seo a d'úsáid feidhmeanna amháin d'achar an leictreon ón núicléas adamhach, d'úsáid siad feidhmeanna a chuir go go follasach leis an bhfad idir an dá leictreon.[6] Le suas le 13 pharaiméadar inathraithe, fuair siad toradh an-ghar don toradh turgnamhach don fhuinneamh díthiomsaithe. D'úsáid breisithe níos déanaí suas le 54 paraiméadar agus bhí siad ag teacht leis leis na turgnaimh roimhe sin. Chuir an t-aireamh seo ina luí ar an bpobal eolaíoch go bhféadfadh teoiric chandamach dearbhú a thabhairt do na turgnamh. Mar sin féin níl aon cheann de na pictiúir fhisiciúla ag an gcur chuige seo den bhfiúsnasc agus de teoiricí na bhfithiseán móilíneach agus tá sé deacair é a leathnú go móilíní níos mó.
Naisc i bhfoirmlí ceimiceacha[cuir in eagar | athraigh foinse]
Toisc go bhfuil adaimh agus móilíní tríthoiseach, tá sé deacair modh amháin a úsáid chun fithiseáin agus naisc a chur in iúl. I bhfoirmlí móilíneacha léirítear na naisc cheimiceacha (nascadh na bhfithiseán) idir adamh ar bhealaí éagsúla ag brath ar an gcineál díospóireachta. Uaireanta, déantar faillí ar roinnt sonraí. Mar shampla, sa cheimic orgánach ní bhaineann duine ach le feidhmghrúpa an mhóilín. Mar sin, féadfar foirmle mhóilíneach eatánóil a scríobh i bhfoirm chomhfhoirmiúil, i bhfoirm thríthoiseach, i bhfoirm iomlán dhéthoiseach (ag léiriú gach nasc gan treoracha tríthoiseacha ar bith), i bhfoirm dhéthoiseach chomhbhrúite (CH3–CH2–OH), trí an grúpa feidhmiúil a scaradh ó chuid eile den mhóilín (C2H5OH), nó ag a chomhábhair adamhacha (C2H6O), de réir an méid a phléitear. Uaireanta, déantar fiú na fiúsleictreoin neamhnascacha (leis na neas-threoracha déthoiseacha) a mharcáil, .i. le haghaidh carbóin eilimintigh .'C'. Féadfaidh roinnt poitigéirí na fithiseáin faoi seach a mharcáil, i.e. an eitéin hipitéisí - (\/C=C/\ −4) a léiríonn féidearthacht fhoirmiú na nasc.
Naisc láidre ceimiceacha[cuir in eagar | athraigh foinse]
| Nascfhaid tipiciúla i bpiciméadair agus nascfhuinnimh i kJ / mol.[7] | ||
| Nasc | Fad (pm) |
Fuinneamh (kJ/mol) |
|---|---|---|
| H — Hidrigin | ||
| H–H | 74 | 436 |
| H–O | 96 | 467 |
| H–F | 92 | 568 |
| H–Cl | 127 | 432 |
| C — Carbón | ||
| C–H | 109 | 413 |
| C–C | 154 | 347 |
| C–C= | 151 | |
| =C–C≡ | 147 | |
| =C–C= | 148 | |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| C–N | 147 | 308 |
| C–O | 143 | 358 |
| C=O | 745 | |
| C≡O | 1,072 | |
| C–F | 134 | 488 |
| C–Cl | 177 | 330 |
| N — Nítrigin | ||
| N–H | 101 | 391 |
| N–N | 145 | 170 |
| N≡N | 110 | 945 |
| O — Ocsaigin | ||
| O–O | 148 | 146 |
| O=O | 121 | 495 |
| F, Cl, Br, I — Halaiginí | ||
| F–F | 142 | 158 |
| Cl–Cl | 199 | 243 |
| Br–H | 141 | 366 |
| Br–Br | 228 | 193 |
| I–H | 161 | 298 |
| I–I | 267 | 151 |
Is éard is naisc láidre ceimiceacha ná na fórsaí ionmóilíneacha a choinníonn adaimh le chéile i móilíní. Cruthaítear nasc láidir ceimiceach ó aistriú nó roinnt leictreon idir ionaid adamhacha agus braitheann sé ar an aomadh leictreastatach idir na prótóin i núicléis agus na leictreoin sna fithiseáin.
Tá difríochtaí idir na cineálacha nasc láidir mar gheall ar an difríocht i leictridhiúltacht na gcomhchodanna. Mar thoradh ar dhifríocht mhór san leictridhiúltacht tá carachtar níos polaí (ianach) sa nasc.
Nasc ianach[cuir in eagar | athraigh foinse]
Is éard is nasc ianach ann ná an fórsa aomtha i gcomhdhúil idir iain le luchtanna urchomhaireacha. Níl aon luach beacht ann a dhéanann idirdhealú idir nascadh ianach agus nascadh chomhfhiúsach, ach is dóigh go mbeidh difríocht leictridhiúltachta os cionn 1.7 ianach agus is dóigh go mbeidh difríocht níos lú ná 1.7 comhfhiúsach.[8] Bíonn iain dearfacha agus diúltacha ar leithligh mar thoradh ar nascadh ianach. Is gnách go mbíonn luchtanna ianacha idir −3e go + 3e. Is gnách go mbíonn nascadh ianach i gceist i salainn mhiotail mar chlóiríd sóidiam (salann mín). Gné tipiciúil de naisc ianacha is ea go bhfoirmíonn na hábhair ina chriostail ianacha, agus sa chás sin níl aon ian péireáilte go sonrach le haon ian amháin eile i nasc treorach ar leith. Ina ionad sin, tá gach cineál iain timpeallaithe le hiain den lucht urchomhaireach, agus tá an spásáil idir é agus gach ceann de na hiain atá luchtaithe go urchomhaireach gar dó, mar an gcéanna do gach adamh mórthimpeall den chineál céanna. Ní hionann an cás seo agus cás na gcriostal comhfhiúsach, áit a bhfuil naisc chomhfhiúsacha idir adamh ar leith fós le haithint ó na hachair is giorra eatarthu, arna dtomhas trí theicnící mar díraonadh x-ghathach.
D’fhéadfadh go mbeadh meascán de speicis chomhfhiúsacha agus ianacha i gcriostail ianacha, mar shampla salainn d'aigéid chasta mar chiainíd sóidiam, NaCN. Taispeánann díraonadh X-gha go bhfuil na naisc idir caitiain shóidiam (Na+) agus ainiain chiainíd (CN−) ianach i NaCN, mar shampla, agus nach bhfuil aon ian sóidiam bainteach le ciainíd ar leith. Mar sin féin, tá na naisc idir adamh C agus N i gciainíd den chineál comhfhiúsach, ionas go mbeidh gach carbón ceangailte go láidir le nítrigin amháin, a bhfuil sé i bhfad níos gaire go fisiciúil dó ná mar atá sé do charbóin nó nítriginí eile i gcriostal ciainíd sóidiam.
Nuair a leáítear criostail den sórt sin go leachtanna, bristear na naisc ianacha ar dtús toisc go bhfuil siad neamhthreorach agus tugann siad deis do na speicis luchtaithe gluaiseacht go saor. Ar an gcaoi chéanna, nuair a thuaslagann salainn den sórt sin in uisce, is gnách go ndéantar na naisc ianacha a bhriseadh tríd an idirghníomhú le huisce, ach leanann na naisc comhfhiúsacha de bheith i seilbh. Mar shampla, i dtuaslagán, bogann na hiain chiainíde, atá fós nasctha le chéile mar iain CN−, go neamhspleách tríd an tuaslagán, mar a dhéanann iain sóidiam, mar Na+. In uisce, bogann iain luchtaithe óna chéile toisc go mbíonn gach ceann acu aomtha níos láidre do roinnt móilíní uisce ná dá chéile. Tá an t-aomadh idir iain agus móilíní uisce, i dtuaslagáin den sórt sin, mar gheall ar chineál nasc ceimiceach lag dépholach. I gcomhdhúile ianacha leáite, leanann na hiain bheith aomtha dá chéile, ach ní ar bhealach ordaithe ná criostalach ar bith.
Nasc comhfhiúsach[cuir in eagar | athraigh foinse]
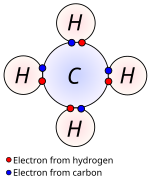
Is éard is nasc comhfhiúsach ann ná nasc atá déanta de leictreoin riarthe. Is cineál nasctha coitianta é nascadh comhfhiúsach ina roinneann dhá adamh nó níos mó fiúsleictreoin a bheag nó a mhór go cothrom. Is é an cineál is simplí agus is coitianta ná nasc singil ina roinneann dhá adamh dhá leictreon. I measc na gcineálacha eile tá an nasc dúbailte, an nasc triarach, naisc aon- agus trí-leictreon, an Nasc trí ionad agus dhá leictreon agus nasc ceithre-lár trí-leictreon.
I nascanna comhfhiúsacha neamhpholacha, is beag an difríocht leictridhiúltachta idir na hadaimh nasctha, 0 go 0.3 de ghnáth. Déantar cur síos ar nascanna i bhformhór na gcomhdhúl orgánach mar nascanna comhfhiúsacha. Taispeánann an íomhá an meatán (CH4), ina ina mbíonn gach ceann de na hadaimh H nasctha leis an adamh lárnach carbóin trí nasc singil comhfhiúsach sa chaoi go mbíonn na hadaimh H uile chomh fada ó chéile agus is féidir. Féach σ naisc agus π naisc le haghaidh tuairiscí faoi chuingir líneach d'fhithiseáin adamhacha nó (CLFA) ar an nascadh sin.
Is minic a chruthaítear móilíní go príomha ó naisc chomhfhiúsacha neamhpholacha atá domheasctha in uisce nó i tuaslagóir polach eile, ach tá siad i bhfad níos intuaslagtha i dtuaslagóirí neamhpholacha mar heacsán.
Is nasc comhfhiúsach é nasc comhfhiúsach polarach a bhfuil carachtar carachtar ianach suntasach aige. Ciallaíonn sé seo go bhfuil an dá leictreon comhroinnte níos gaire do cheann de na hadaimh ná an ceann eile, ag cruthú éagothroime luchtaithe. Tarlaíonn naisc den sórt sin idir dhá adamh a bhfuil leictridhiúltacht measartha difriúil acu agus is cúis le idirghníomhaithe déphol-déphol. Is é 0.3 go 1.7 an difríocht leictridhiúltachta idir an dá adamh sna naisc seo.
Naisc shingile agus iolracha[cuir in eagar | athraigh foinse]
Fabhraítear; nasc singil nuair a riartar aon phéire leictreon, nasc dúbhailte nuair a riartar dhá phéire leictreon, agus nasc triarach nuair a riartar trí phéire leictreon.
Tá fiúsleictreon amháin ag an adamh hidrigine (H). Ansin is féidir le dhá adamh hidrigine móilín a chruthú, á gcoinneáil le chéile ag an bpéire leictreon comhroinnte. Anois tá cumraíocht an thrithgháis héiliam ag gach adamh H anois. Cruthaíonn an dís leictreon nasc singil comhfhiúsach. Méadaíonn dlús leictreon an dá leictreon nasctha seo sa réigiún idir an dá adamh ó dhlús dhá adamh H neamh-idirghníomhach.

Tá dhá phéire leictreon comhroinnte i nasc dúbailte, ceann i sigme-naisc agus ceann i pí-naisc, le dlús leictreon dírithe ar dhá thaobh urchomhaireacha den ais idir-núicléach. Is éard atá i nasc triarach comhfhiúsach ná riaradh trí dhís leictreon, a chruthaíonn sigme-nasc amháin agus dhá phí-nasc. Sampla is ea nítrigin. Tá naisc cheathrúla agus naisc níos airde an-annamh agus ní tharlaíonn siad ach idir adamh miotail thrasdultacha áirithe.
Nasc comhfhiúsach comhordanáideach(nasc dépholach)[cuir in eagar | athraigh foinse]

Is éard is Nasc comhfhiúsach comhordanáideach ann ná cineál naisc chomhfhiúsaigh dé-ionad, déleictreon a dhíorthaíonn an dá leictreon ón adamh céanna. Mar shampla, cruthaíonn trífhluairíd bhóróin (BF3) agus amóinia (NH3) aduct nó [[ coimpléasc comhordúcháin] ] F3B ← NH3 le nasc B-N ina roinntear péire aonair leictreon ar N le fithiseán adamhach folamh ar B. Déantar cur síos ar BF3 le fithiseán folamh mar ghlacóir leictreondíse nó aigéad Lewis, nuair is féidir deontóir leictreondíse nó bun Lewis a thabhairt ar NH3 le dís aonair gur féidir a bheith roinnte. Roinntear na leictreoin a bheag nó a mhór go cothrom idir na hadaimh i gcodarsnacht le nascadh ianach. Taispeántar nascadh den sórt sin le saighead atá dírithe ar aigéad Lewis.
De ghnáth bíonn coimpléisc mhiotail trasdultach ceangailte ag naisc chomhfhiúsacha chomhordaithe. Mar shampla, imoibríonn an t-ian Ag+ mar aigéad Lewis le dhá mhóilín de bhun Lewis NH3 chun an ianchoimpléasc Ag(NH3)2+ a dhéanamh, a bhfuil dhá nasc comhfhiúsach Ag ← N acu.
Nascadh miotalach[cuir in eagar | athraigh foinse]
I nascadh miotalach, bíonn na leictreoin nasctha dílogánaithe thar laitíse adamh. I gcodarsnacht leis sin, i gcomhdhúile ianacha, bíonn suíomhanna na leictreon nasctha agus a luchtanna statach. Mar thoradh ar shaorghluaiseacht nó dílogánú na leictreon nasctha bíonn airíonna miotalacha clasaiceacha ar nós loinnreach (frithchaiteacht solais dhromchla), seoltacht leictreach agus teirmeach, insínteacht, agus neart teanntachta ard.
Nascadh idirmhóilíneach[cuir in eagar | athraigh foinse]
Is féidir ceithre chineál nasc bunúsach a fhoirmiú idir dhá mhóilín nó níos mó (ach ab é sin neamhcheangailte) iain nó adaimh. Is cúis le fórsaí idirmhóilíneacha ina gcúis le móilíní a bheith aomtha nó éartha óna chéile. Go minic, sainmhíníonn siad seo cuid de na tréithe fisiciúla (amhail an leáphointe) na substainte.
- Cuirfidh difríocht mhór i leictridhiúltacht idir dhá adamh nasctha luchtdheighilt buan, nó dépholl, i bhfeidhm i móilín nó in ian. Is féidir le dhá mhóilín nó ian nó níos mó, a bhfuil déphoil bhuana acu idirghníomhú laistigh de idirghníomhaíocht déphol-déphol. Ar an meán, beidh na leictreoin nasctha i móilín nó in ian níos gaire don adamh níos leictridhiúltacha, níos minice ná an t-adamh is lú leictridhiúltach, rud a fhágfaidh go mbeidh luchtanna páirteacha ar gach adamh agus fórsaí leictreastatacha a chruthú idir móilíní nó iain.
- Is sampla láidir i ndáiríre é nasc hidrigine d'idirghníomhaíocht idir dhá bhuandhéphol. Is é an difríocht mhór i leictridhiúltachtaí idir hidrigin agus aon cheann de na hadaimh fluairín, nítrigin agus ocsaigin, in éineacht lena bpéirí aonair leictreon, a chruthaíonn fórsaí leictreastatacha idir móilíní. Tá nasisc hidrigine freagrach as fiuchphointí arda uisce agus amóinia maidir lena n-analógacha níos troime.
- Eascraíonn an fórsa easraithe Londain mar gheall ar dhéphoill mheandaracha in adaimh in aice láimhe. Toisc nach bhfuil lucht diúltach an leictreoin aonfhoirmeach timpeall an adaimh iomláin, bíonn éagothroime
luchtaithe ann i gcónaí. Spreagfaidh an lucht beag seo dépholl comhfhreagrach luchta i móilín in aice láimhe, rud a fhágfaidh go mbeidh aomadh idir an dá cheann. Ansin bogann an leictreon go dtí cuid eile den néal leictreon agus bristear an aomadh.
- Tarlaíonn caitian pí-idirghníomhaíocht idir pí-nasc agus an caitian.
Teoiricí maidir le nascadh ceimiceach[cuir in eagar | athraigh foinse]
Sa teorainn (neamhréadúil) de nascadh ianach "íon", tá leictreoin locáilte go foirfe ar cheann den dá adamh sa nasc. Is féidir naisc den sórt sin a thuiscint leis an bhfisic chlasaiceach. Contanam iseatrópach de phoitéinsil leictreastatacha atá mar chomhartha sóirt ag fórsaí idir na hadaimh. Tá a gcuid méide i gcomhréir shimplí leis an difríocht an luchta.
Tuigtear fiúsnaisc níos fearr trí teoiric an fhiúsnaisc (TFN) nó trí theoiric na bhfithiseán móilíneach (TFM). Is féidir airíonna na n-adamh atá i gceist a thuiscint trí choincheapa ar nós na huimhreach ocsaídiúcháin, an luchta fhoirmiúil, agus na leictridhiúltachta a úsáid. Ní shanntar dlús leictreon laistigh de naisc d'adamh aonair, ach ina ionad sin déantar é a dhílogánú idir adaimh. I dteoiric an fhiúsnaisc, samhlaítear ar nascsadh mar phéirí a roinntear na leictreoin a riartar idir dhá adamh agus fabhraíonn dis riartha nasc idir an dá adamh agus dáiltear an lucht go cothrom eatarthu. Méadaíonn na coincheapa hibridithe fhithisigh agus athshondais an nóisean bunúsach seo den nasc leictreondíse. I dteoiric na bhfithiseán móilíneach, breathnaítear ar nascadh a bheith dílogánta agus cionroinnte i bhfithiseáin a shíneann ar fud an mhóilín agus a chuirtear in oiriúint dá airíonna siméadrachta, go hiondúil trí chuingir líneach de fhithiseáin adamhacha (CLFA) a mheas.
Tá teoiric an fhiúsnaisc iomasach go ceimiceach trí bheith logánaithe go spásúil, rud a fhágann gur féidir aird a dhíriú ar na codanna den mhóilín atá i mbun athraithe cheimicigh. I gcodarsnacht leis sin, tá fithiseáin mhóilíneacha níos “nádúrtha” ó thaobh an dearcaidh meicniúil chandamach, le fuinnimh fhithiseacha suntasach go fisiciúil agus nasctha go díreach le fuinnimh ianúcháin turgnamhacha ó speictreascópacht fhótaileictreonach. Dá bhrí sin, is minic a fhéachtar ar theoiric an fhiúsnaisc agus ar theoiric na bhfithiseán móilíneach mar go bhfuil siad in iomaíocht ar a chéile, ach mar sin féin, go bhfuil creataí comhlántacha acu a thugann léargas difriúil ar chórais cheimiceacha. Mar chur chuige maidir le teoiric an struchtúir leictreonaigh, is féidir le modhanna TFN agus TFM araon comhfhogasú a thabhairt d’aon leibhéal cruinnis atá ag teastáil, i bprionsabal ar a laghad. Ar leibhéil níos ísle, áfach, tá difríochtaí sna comhfhogasúcháin, agus d’fhéadfadh go mbeadh cur chuige amháin níos oiriúnaí do ríomhanna a bhaineann le córas nó maoin áirithe ná an ceann eile.
Murab ionann agus na fórsaí Coulomb atá siméadrach go sféarúil i naisc ianacha íona, is gnách go mbíonn naisc chomhfhiúsacha treoch agus ainiseatrópach. Is minic a dhéantar iad seo a aicmiú bunaithe ar a siméadracht maidir le plána móilíneach mar sigme-naisc agus pí-naisc. Go ginearálta, cruthaíonn adaimh naisc atá idirmheánach idir ianach agus comhfhiúsach, ag brath ar leictridhiúltacht choibhneasta na n-adamh atá i gceist. Tugtar naisc chomhfhiúsacha pholacha ar naisc den chineál seo.[9]
Féach freisin[cuir in eagar | athraigh foinse]
- Nascfhuinneamh
- Nasc comhfhiúsach
- Nasc hidrigine
- Nasc halaigine
- Nascadh ianach
- Nascadh miotalach
- Pí-nasc
- Sigme-nasc
- Nasc trí-lár agus dhá leictreon
- Nasc trí-lár ceithre-leictreon
- Fórsa van der Waals
Tagairtí[cuir in eagar | athraigh foinse]
- ↑ Rioux, F. (2001). "The Covalent Bond in H2". The Chemical Educator 6 (5): 288–290. doi:.
- ↑ Lewis, Gilbert N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society 38 (4). doi:. Curtha i gcartlann 2013-11-25 ar an Wayback Machine a copy Curtha i gcartlann 2021-04-18 ar an Wayback Machine
- ↑ Бор Н. (1970). "Избранные научные труды (статьи 1909–1925)" 1. М.: «Наука».
- ↑ Svidzinsky, Anatoly A. (2005). "Bohr's 1913 molecular model revisited". Proceedings of the National Academy of Sciences 102 (34 [1]): 11985–11988. doi:. PMID 16103360. Bibcode: 2005PNAS..10211985S.
- ↑ Laidler, K. J. (1993). "The World of Physical Chemistry". Oxford University Press.
- ↑ James, H.H. (1933). "The Ground State of the Hydrogen Molecule". Journal of Chemical Physics 1 (12): 825–835. doi:. Bibcode: 1933JChPh...1..825J.
- ↑ Bond Energies. https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Chemical_Bonding/Fundamentals_of_Chemical_Bonding/Bond_Energies
- ↑ Atkins, Peter (1997). "Chemistry: Molecules, Matter and Change": 294–295. New York: W.H. Freeman & Co..
- ↑ Hussey, Matt (2011). "Nasc ceimiceach". Fréamh an Eolais. Coiscéim. p. 477.
Naisc sheachtracha[cuir in eagar | athraigh foinse]
- W. Locke (1997). Introduction to Molecular Orbital Theory. Retrieved May 18, 2005.
- Carl R. Nave (2005). HyperPhysics. Retrieved May 18, 2005.
- Linus Pauling and the Nature of the Chemical Bond: A Documentary History Curtha i gcartlann 2008-02-14 ar an Wayback Machine. Retrieved February 29, 2008.
| Tá an t-alt seo bunaithe ar ábhar as Fréamh an Eolais, ciclipéid eolaíochta agus teicneolaíochta leis an Ollamh Matthew Hussey, foilsithe ag Coiscéim sa bhliain 2011. Tá comhluadar na Vicipéide go mór faoi chomaoin acu beirt as ucht cead a thabhairt an t-ábhar ón leabhar a roinnt linn go léir. |
| Is síol é an t-alt seo. Cuir leis, chun cuidiú leis an Vicipéid. Má tá alt níos forbartha le fáil i dteanga eile, is féidir leat aistriúchán Gaeilge a dhéanamh. |
