Carbón
 | |
| Substaint cheimiceach | dúil cheimiceach agus atmophile element (en) |
|---|---|
| Carbón sa tábla peiriadach | |
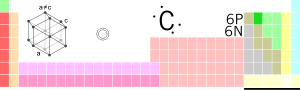
| Siombail cheimiceach | C |
| Uimhir adamhach | 6 |
| Mais adamhach | 12.011 |
| Cumraíocht leictreon | 1s² 2s² 2p² agus [He] 2s² 2p² |
| Peiriad, Grúpa | peiread 2 grúpa 14 |
| Airíonna fisiceacha | |
| Dlús | 2.26 agus 3.51 kg/m⁻³ |
| Leictridhiúltacht | 2.55 |
| Ga ianach | 0.15 agus 0.16 |
| Stair | |
| Aimsitheoir | Antoine Lavoisier |
| Fionnachtain | 1789 |
| Eapainm | gual |
 | |
Is é an carbón dúil uimhir a 6, agus is é C siombail cheimiceach na dúile seo. Neamh-mhiotal atá ann agus é in ann ceithre nasc comhfhiúsacha a cheangal. Níl srian ná teorainn leis na comhdhúile éagsúla is féidir a chur i dtoll le chéile as na hadaimh charbóin, agus mar sin, brainse ceimice iontu féin iad comhdhúile an charbóin - brainse ar a dtugtar an cheimic orgánach.
Iseatóip an charbóin
[cuir in eagar | athraigh foinse]Tá trí iseatóp nádúrtha ag an gcarbón, mar atá, an dá iseatóp cobhsaí 12C (99 % de charbón an dúlra), 13C (1 %) agus an raidiseatóp 14C, nó an radacarbón, nach mbíonn ach iarsmaí de sa charbón nádúrtha. Tá leathré réasúnta gairid aige, 5730 bliain. Ní athraíonn flúirse an radacarbóin in orgánaigh bheo a fhad is a mhaireann siad, ach nuair a bhásóidh siad, stopfaidh an soláthar radacarbóin ón timpeallacht. Mar sin, is féidir aois na n-iarsmaí orgánacha a oibriú amach trí fhlúirse an radacarbóin iontu a thomhas. Dátú radacarbóin a thugtar air sin, agus é ag teacht isteach áisiúil ag na seandálaithe, mar shampla.
Allatróip an charbóin
[cuir in eagar | athraigh foinse]Tá foirmeacha éagsúla allatrópacha ag an gcarbón, agus is iad an diamant agus an ghraifít an dá allatróp is coitianta. Tá struchtúr tríthoiseach ag an diamant a choinníonn le chéile é go daingean. Ón taobh eile de, tá criostal na graifíte comhdhéanta as "plátaí" déthoiseacha d'adaimh charbóin nach bhfuil ach naisc laga eatarthu, rud a chiallaíonn go bhfuil an ghraifít sobhriste go leor. Mar sin, cé gurb iad na hadaimh chéanna atá sa dá chineál carbóin, tá siad an-difriúil: tá an diamant crua geal trédhearcach, agus tá an ghraifít bog dubh teimhneach. Ní féidir leis an diamant leictreachas a iompar, ós rud é go bhfuil na leictreoin suite go daingean sna naisc chomhfhiúsacha, agus ní féidir leo dul timpeall sa chriostal. Scéal eile é scéal na graifíte arís. Bíonn cead a gcos ag na leictreoin idir na "plátaí", ionas gur féidir leo sruth leictreach a iompar i gcriostal na graifíte. Mar sin, tá seoltacht áirithe ag baint leis an ngraifít, cé nach féidir a rá gur seoltóir maith leictreachais a bheadh inti.
Tá a leithéid d'allatróp ann freisin agus carbón dímhorfach, is é sin, carbón nach bhfuil struchtúr soiléir criostail aige. Go dtí le déanaí, shíltí gur carbón dímhorfach a bhí i gceist le gual agus le súiche, ach ní mar sin atá - le fírinne, tá an dá chuid sin comhdhéanta as criostail bheaga bhídeacha graifíte. Inniu féin, tugtar "carbón dímhorfach" ar an dá chineál seo go minic, áfach. Is féidir carbón fíor-dhímhorfach a tháirgeadh, ach tá sé deacair.
Tá a leithéid d'allatróp ann fós agus lonsdaeilít, nó diamant heicseagánach. Tá struchtúr heicseagánach ag an lonsdaeilít, cosúil leis an ngraifít, ach tá sí crua, cosúil leis an diamant. Na heisimil den lonsdaeilít a ndearnadh taighde orthu, ní raibh siad chomh crua leis an diamant, ach creidtear go raibh na samplaí seo truaillithe ag substaintí coimhthíocha, agus go bhféadfadh lonsdaeilít ghlan an diamant féin a shárú ar a chruacht.

Na fullairéiní
[cuir in eagar | athraigh foinse]Le déanaí, d'éirigh leis na heolaithe allatróip nua charbóin a shintéisiú sna saotharlanna ina mbíonn na hadaimh charbóin curtha le chéile i móilíní ar déanamh tríthoiseeach éigin, siméadrach go minic. Tugtar fullairéiní ar na móilíní seo, nó nuair a cruthaíodh na chéad mhóilíní den chineál seo timpeall ar an mbliain 1985, bhí na ceimiceoirí den bharúil go raibh siad cosúil le foirgnimh an ailtire nua-aimseartha Mheiriceánaigh Richard Buckminster Fuller. Is é "millín Bucky" an fhullairéin is cáiliúla, b'fhéidir - go bunúsach, móilín ar déanamh liathróide atá ann, agus trí scór adamh carbóin i ngach liathróid den chineál seo.
Comhdhúile neamhorgánacha an charbóin
[cuir in eagar | athraigh foinse]An dé-ocsaíd charbóin
[cuir in eagar | athraigh foinse]Is í an uimhir ocsaídiúcháin is minicí atá ag an gcarbón ná +4. Sin é an uimhir ocsaídiúcháin atá aige sa dé-ocsaíd charbóin, CO2. Tá ról tábhachtach ag an dé-ocsaíd charbóin san fhótaisintéis, nó baineann na plandaí dé-ocsaíd charbóin den atmaisféar, agus iad ag déanamh móilíní níos casta astu, cosúil leis na siúcraí. Ón taobh eile de, is í an dé-ocsaíd charbóin táirge dócháin an charbóin agus na móilíní orgánacha a bhfuil carbón iontu. Mar sin, nuair a dhóitear siúcra sna horgánaigh bheo mar fhoinse fuinnimh, is í an dé-ocsaíd charbóin a tháirgtear. Sin é an tuige go n-análaíonn an duine féin ocsaigin isteach agus dé-ocsaíd charbóin amach, mar shampla.
Is gás í an dé-ocsaíd charbóin le teocht an tseomra, agus ní féidir é a iompú ina leacht gan ardbhrú a oibriú uirthi. Leis an ngnáthbhrú, deascfaidh sé go díreach ó ghás go criostail sholadacha ag teocht ocht gcéim déag is trí scór faoin nialas de réir Celsius (-78 °C), agus néalóidh na criostail ar ais go gás má sháraítear an teocht seo.
An t-aigéad carbónach
[cuir in eagar | athraigh foinse]Má thuaslagtar dé-ocsaíd charbóin san uisce, gheofar aigéad carbónach H2CO3. Is é an tuiscint a bhí ag na ceimiceoirí riamh nach féidir an t-aigéad carbónach a aonrú mar shubstaint ghlan, ach sa bhliain 1991, d'éirigh leis na saineolaithe sa Goddard Space Flight Center, lárionad taighde de chuid an NASA, samplaí d'aigéad carbónach glan a tháirgeadh. Dealraíonn sé, áfach, go dtitfidh móilíní an aigéid charbónaigh as a chéile le huisce agus dé-ocsaíd charbónach a dhéanamh a thúisce is a rachaidh oiread is aon mhóilín uisce amháin i dteagmháil leo.
Na carbónáití
[cuir in eagar | athraigh foinse]Cibé faoi sin, is féidir salainn an aigéid seo a tháirgeadh - carbónáití, mar a thugtar orthu, agus iad sách coitianta i measc na mianraí nádúrtha: an chailcít, nó an charbónáit chailciam CaCO3, an smitsinít nó an charbónáit since ZnCO3, an ródacróisít nó an charbónáit mhangainéise MnCO3, an rutarfoirdín nó an charbónáit úráinile UO2CO3, agus a lán eile.
An aonocsaíd charbóin
[cuir in eagar | athraigh foinse]Is í an uimhir ocsaídiúcháin atá ag an gcarbón sa chomhdhúil thábhachtach seo ná +2, agus is í an fhoirmle cheimiceach atá aici ná CO. Nimh láidir atá inti agus í in ann dul in áit an mhóilín ocsaigine i haemaglóibín na fola, ionas nach féidir leis an haemaglóibín tuilleadh ocsaigine a iompar. Sin é an dóigh a n-oibríonn an t-ian ciainíde fosta, agus é cosúil leis an aonocsaíd charbóin ó thaobh an struchtúir leictreonaigh de. Níl an aonocsaíd charbóin chomh sothuaslagtha san fhuil agus an chiainíd, ach ón taobh eile de, níl boladh ar bith as an aonocsaíd charbóin.
Cruthaítear aonocsaíd charbóin nuair a bhítear ag dó carbóin agus an ocsaigin gann. Toradh don dóchán neamhfhoirfe í. Mar sin, is féidir aonocsaíd charbóin a dhó go dé-ocsaíd charbóin, agus sna laethanta a bhí, bhaintí úsáid áirithe aisti mar bhreosla.
Le linn an Uilelosctha, bhain na Naitsithe triail as an aonocsaíd charbóin mar nimh le daoine a mharú. Mharaigh siad daoine easlána sa Ghearmáin féin le linn an fheachtais eotanáise úd "T4", agus chuir siad príosúnaigh i veaineanna gan sceithphíopaí: chuaigh na gáis sceite isteach i gcúl na veain, agus stiúg na príosúnaigh leis an aonocsaíd charbóin. Sa deireadh, áfach, chuaigh na Naitsithe i muinín na ciainíde agus an tseomra gáis de rogha ar an aonocsaíd charbóin agus na veaineanna, ó fuair siad nach raibh an modh oibre seo sách éifeachtach le sluaite móra daoine a bhású.
Na Cairbídí
[cuir in eagar | athraigh foinse]Téann an carbón i gcomhdhúile le miotail imoibríocha le cairbídí agus le haicéitilídí (déchairbídí) a dhéanamh. Is iad an t-ian cairbíde (C4-) agus an t-ian déchairbíde (C22-) na hiain dhiúltacha sna comhdhúile ianacha seo. San ian aicéitilíde, tá nasc triarach idir an dá adamh carbóin, cosúil leis an aicéitiléin H2C2, agus má thagann an t-ian seo i dteagmháil leis an uisce, imoibreoidh sé leis, ionas go gcruthófar aicéitiléin.
Cairbídí de chineál eile iad cairbídí na neamh-mhiotal, cosúil leis an gcairbíd sileacain SiC, a dtugtar carbaram uirthi freisin. Tá sí crua, cosúil leis an diamant, agus an struchtúr criostalta céanna inti.
Na Comhdhúile Orgánacha
[cuir in eagar | athraigh foinse]Tá na hadaimh charbóin in ann naisc chomhfhiúsacha a cheangal dá chéile le slabhraí fada a dhéanamh. Tugtar caitéanú ar an bpróiseas seo. Bíonn na naisc chomhfhiúsacha idir adaimh charbóin láidir cobhsaí, agus mar sin, níl teorainn ar bith leis na struchtúir chasta cheimiceacha is féidir a thógáil as na hadaimh charbóin (in éineacht le dúile eile, ar ndóigh, go háirithe an hidrigin). Tá comhdhúile caitéanaithe an charbóin i bhfad bhfad níos líonmhaire ná comhdhúile na ndúl ceimiceach eile nach bhfuil carbón ar bith iontu, agus mar sin, is follasach gur brainse ceimice ann féin é ceimic an charbóin.
Ar chúiseanna stairiúla, tugtar comhdhúile orgánacha ar chomhdhúile caitéanaithe an charbóin. Ar dtús, shíltí nach raibh comhdhúile den chineál sin le fáil ach sna horgánaigh bheo agus ina n-iarsmaí, agus go raibh fórsaí ceimiceacha ar leith, cineál draíocht nó druagántacht, a bhí riachtanach le struchtúir chasta den chineál seo a chur i dtoll le chéile. Is é an téarma a bhí ag na luathcheimiceoirí ar an bhfórsa rúndiamhair seo ná vis vitalis, fórsa beatha, nó beathfhórsa. Chreid Louis Pasteur, mar shampla, go raibh beathfhórsa sa dúlra, agus is dócha go raibh baint ag an tuairim seo leis an gcreideamh láidir Críostaí a bhí aige. - Mar sin, ba dual do leithéidí Pasteur a chreidiúint gurb ionann, go bunúsach, taighde na struchtúr caitéanaithe carbón agus taighde ceimiceach an dúlra. D'imigh sin agus tháinig seo, áfach, nó tugtar bithcheimic ar cheimic an dúlra, agus is í an cheimic orgánach taighde na gcomhdhúl casta carbóin, beag beann ar cé acu an dúlra nó an duine a chruthaíonn iad.
Na Hidreacarbóin
[cuir in eagar | athraigh foinse]Is iad na hidreacarbóin na comhdhúile orgánacha is simplí. Níl iontu ach carbón agus hidrigin, ach má ghlactar leis go bhfuil aon nasc comhfhiúsach amháin ag an hidrigin agus ceithre cinn ag an gcarbón, féadfar na mílte hidreacarbón a phleanáil ar an bpáipéar agus iad a shintéisiú ansin sa leabharlann. Scéal eile é, áfach, go bhfuil struchtúr tríthoiseach ag na hidreacarbóin, agus gur féidir nach bhfuil slí ag na brainsí agus na craobhacha go léir sa spás mar a bhí ar an bpáipéar.
Na hAlcáin
[cuir in eagar | athraigh foinse]Is iad na hidreacarbóin sháithithe, nó na halcáin, an cineál is simplí de na hidreacarbóin. Níl ach naisc shingile idir na hadaimh charbóin iontu. Glactar leis an meatán CH4 mar alcán agus mar chomhdhúil orgánach freisin, cé nach bhfuil carbón caitéanaithe ann. Alcáin eile iad an t-eatán CH3CH3, an propán CH3CH2CH3, an bútán CH3CH2CH2CH3, an peantán CH3CH2CH2CH2CH3, an heacsán CH3CH2CH2CH2CH2CH3 agus araile. Is féidir foirmle shimplí gach alcán a fhréamhú ón bhfoirmle ghinearálta CnH2n + 2. Ón bpeantán ar aghaidh, ainmnítear na halcáin as na huimhreacha Gréigise a mhíníonn líon na n-adamh carbóin sa slabhra carbóin: heacsán (sé adamh carbóin), heaptán (seacht n-adamh carbóin), ochtán (ocht n-adamh carbóin), naonán (naoi n-adamh carbóin), deacán (deich n-adamh carbóin), aondeacán (aon adamh déag), dódeacán (dhá adamh déag), trídeacán (trí adamh déag), teitrideacán (ceithre adamh déag), peintideacán (cúig adamh déag), heicsideacán (sé adamh déag), heiptideacán (seacht n-adamh déag), ochtaideacán (ocht n-adamh déag), naonaideacán (naoi n-adamh déag)...
Na halcáin a luadh thuas, is alcáin normalacha iad - is é sin, tá slabhra díreach gan chraobhacha iontu. Is féidir leis na móilíní alcáin a bheith craobhach freisin. Ainmnítear na móilíní craobhacha as an slabhra is faide a aithnítear iontu, agus caitear leis na craobhacha mar mhalartaithe - is é sin, mar a bheadh grúpaí adamhacha iontu a tháinig in áit an adaimh hidrigine sa bhunstruchtúr. Amach ón mbútán normalach, tá an fhoirmle C4H10 ag hidreacarbón amháin eile, CH3CH(CH3)CH3 freisin. Deirtear gur isiméirí iad an hidreacarbón seo agus an bútán normalach. Is minic a thugtar iseabútán ar an hidreacarbón seo, ach, le fírinne, is é an t-ainm córasach atá air ná 2-meitiolprópán. Aithnítear gurb é slabhra an trí adamh carbóin, nó an slabhra própáin, an slabhra is faide sa mhóilín. Feicimid go bhfuil grúpa meitile, -CH3, ag gobadh amach as an slabhra seo. San ainmniú, caithimid leis an ngrúpa seo mar a bheadh malartaí ann a tháinig in áit ceann de na hadaimh hidrigine i móilín an phrópáin.
Na hAilcéiní
[cuir in eagar | athraigh foinse]Tugtar ailcéiní ar na hidreacarbóin a bhfuil aon nasc dúbailte amháin iontu. Is í an eitéin, CH2=CH2 an ceann is simplí acu. Tugtar eitiléin uirthi freisin, ach sa téarmaíocht chaighdeánaithe, tá an t-ainm sin teoranta don ghrúpa adamhach a gheofar nuair a osclófar ceann den dá nasc idir an dá adamh carbóin, -CH2-CH2-. Mar shampla, is féidir clóiríd eitiléine a thabhairt ar an 1,2-déchlóireatán CH2ClCH2Cl.
Is féidir olaifíní a thabhairt ar na hailcéiní freisin. Téarma é seo a úsáidtear i scagadh na hartola ach go háirithe.
Is hidreacarbóin neamhsháithithe iad na hailcéiní, mar a deirtear. Is éard is ciall dó sin ná go bhfuil sé de chlaonadh iontu leathnasc an naisc dhúbailte a oscailt in imoibriú ceimiceach agus comhdhúil sháithithe a chruthú, is é sin, comhdhúil nach bhfuil ach naisc shingile idir na hadaimh charbóin inti. Mar sin, is é an suimiúchán an cineál imoibriú is dual don ailcéin. Is é is brí le suimiú i gcomhthéacs na ceimice orgánaí ná go n-osclaítear an leathnasc ionas gur féidir leis an imoibrí naisc a cheangal de na hadaimh charbóin a raibh an nasc dúbailte eatarthu féin. An móilín nua a fhaightear, tá an dá mhóilín "suimithe" ann a d'imoibrigh le chéile.
Cineálacha éagsúla suimiúcháin ag na hailcéiní is ea iad:
- an hidriginiú. Is ionann é agus an ailcéin a thiontú go halcán. Go tipiciúil, úsáidtear platanam nó miotail ghaolmhara, go háirithe róidiam nó pallaidiam leis an imoibriú seo a chatalú, ós rud é go bhfuil na miotail seo in ann gás hidrigine a ionsú - a "ól isteach" - agus a stóráil.
Sampla: CH2=CH2 + H2 -> CH3CH3 - má hidriginítear eitéin, gheofar eatán.
- an halaiginiú. Is é sin, suimiú na halaigine (fluairín, clóirín, bróimín, iaidín) leis an ailcéin. Mar sin, faightear alcán dé-halaiginithe, is é sin, alcán ina bhfuil dhá adamh halaigine tagtha in áit dhá adamh hidrigine.
- an hidreahalaiginiú. Is é sin, suimiú na halaiginíde hidrigine (HF, HCl, HBr, HI) leis an ailcéin. Faightear alcán a bhfuil aon adamh halaigine amháin tagtha in áit aon adamh hidrigine amháin.
