An difríocht idir athruithe ar: "Ceimic"
No edit summary |
m →Sanasaíocht: nascanna a chur leis |
||
| Líne 163: | Líne 163: | ||
# Ailceimic na hÉigipte [5,000 BC – 400 BC], Leabharlann Chathair Alastair |
# Ailceimic na hÉigipte [5,000 BC – 400 BC], Leabharlann Chathair Alastair |
||
# Ailceimic na Gréige [332 BC – 642 AD], na Greigigh i réim i gCathair Alastair |
# Ailceimic na Gréige [332 BC – 642 AD], na Greigigh i réim i gCathair Alastair |
||
# Ailceimic na nArabach [642 AD – 1200], na |
# Ailceimic na nArabach [642 AD – 1200], na hArabaigh i réim i gCathair Alastair, e.g. Is é [[Jabir]] an príomh-cheimiceoir. |
||
# Ailceimic na hEorpa [1300 – Inniu], Gerber a thóg ar Cheimic na nArabach |
# Ailceimic na hEorpa [1300 – Inniu], Gerber a thóg ar Cheimic na nArabach |
||
# Ceimic [1661], Boyle ''The Sceptical Chemist'' |
# Ceimic [1661], [[Robert Boyle|Boyle]] ''The Sceptical Chemist'' |
||
# Ceimic [1787], Lavoisier ''Élémentaire de Chimie'' |
# Ceimic [1787], [[Antoine Lavoisier|Lavoisier]] ''Élémentaire de Chimie'' |
||
# Ceimic [1803], [[Dalton]] ''Atomic Theory'' |
# Ceimic [1803], [[John Dalton|Dalton]] ''Atomic Theory'' |
||
== Féach freisin == |
== Féach freisin == |
||
Leagan ó 22:14, 4 Eanáir 2020
Is í an cheimic an brainse eolaíochta a dhéanann taighde ar an damhna ar leibhéal na n-adamh agus na móilíní. Is é is príomhábhar taighde don cheimic na dúile ceimiceacha agus an dóigh a dtéann siad le chéile in imoibrithe le comhdhúile ceimiceacha a dhéanamh.

Brollach
Is gnách an "eolaíocht lárnach" a thabhairt ar an gceimic, nó ceanglaíonn sí dá chéile na brainsí eile eolaíochta, is é sin, an fhisic, an bhitheolaíocht, an mhíochaine agus an gheolaíocht. Is é is cúis leis an gcomhcheangal seo ná go mbíonn fo-dhisciplíní na mbrainsí seo eolaíochta ag baint úsáide as coincheapa de chuid na mbrainsí eile. Mar sampla, téann an cheimic fhisiceach i dtuilleamaí na tuisceana atá ag an bhfisic ar an damhna ar leibhéal na n-adamh agus na móilíní.

Stair na Ceimice
Is deacair a rá cathain a thosaigh stair na ceimice dáiríre. I measc na gceimiceoirí is luaithe, is féidir na mná Bablónacha a bhí ag driogadh cumhrán a lua. I bhfad roimhe sin, áfach, fuair na daoine amach go raibh ábhair áirithe indóite agus ábhair eile dodhóite. Fórsa rúndiamhair ab ea an tine, a bhí in ann ábhar a chlaochlú go hábhar eile, rud ba dhúspéis leis na daoine. Ba í an tine a chabhraigh leis an duine iarann nó gloine a dhéanamh an chéad uair riamh. Nuair a d'éirigh sé coitianta dearcadh ar an ór mar mhiotal luachmhar, chuir na daoine suim san ailceimic. Is é is ailceimic ann ná na hiarrachtaí a rinneadh leis an ór a dhéanamh go sintéiseach, gan é a bhaint as an talamh. Ní raibh i gceist leis an ailceimic go fóill ach réamheolaíocht nó próta-eolaíocht, ach mar sin féin, d'fhoghlaim agus d'fhorbair na hailceimiceoirí modhanna oibre a chuaigh chun tairbhe na bhfíorcheimiceoirí i ndiaidh thréimhse na hailceimice.
D'aimsigh na hailceimiceoirí go leor próiseas ceimiceach, rud a chuidigh le forbairt na ceimice nua-aimseartha. I gcaitheamh na staire, thréig na hailceimiceoirí ab fhearr an rúndiamhracht agus na piseoga a bhí ag roinnt leis an ailceimic, agus iad ag fáil eolais ar fhíornádúr an damhna, ionas gur tháinig dearcadh ní b'eolaíochtúla chucu dá n-ainneoin. I measc rogha na n-ailceimiceoirí, is fiú Geber, nó Abu Musa Jabir ibn Hayyan, agus Paracelsus, nó Philippus Theophrastus Aureolus Bombastus von Hohenheim, a lua. Ba é Robert Boyle, áfach, a d'oscail an geata ón ailceimic go dtí an cheimic. Léiriú maith ar a dhearcadh is ea teideal an tsaothair ba tábhachtaí dár scríobh sé, mar atá, The Skeptical Chymist, is é sin, An tAilceimiceoir Sceiptiúil. Mar sin féin, bhí an Baoilleach ina ailceimiceoir i gcónaí. Ba é Antoine Laurent Lavoisier an chéad cheimiceoir nua-aimseartha, ámh. B'eisean a leag amach Dlí Imchoimeádta na Maise sa bhliain 1783, agus b'eisean ba thúisce a tháinig ar an tuiscint cheart ar an dóchán mar phróiseas ceimiceach. Roimh a lá féin, chreid na heolaithe gurbh ionann an dóchán agus an breosla a bheith ag tabhairt uaidh "flógastón", dearcadh a bhí bunaithe, ar bhealach, ar an míthuiscint sheanársa gur cineál damhna nó dúile atá sa teas. Thaispeáin Lavoisier nach amhlaidh a bhí, ach gurbh é an rud a bhíonn ag titim amach le linn an dócháin ná go bhfuil an breosla ag cumasc leis an ocsaigin.
Ceann de na dúile ceimiceacha ab ea an ocsaigin, agus thóg sé na blianta fada ar na heolaithe na dúile go léir a aithint, a aonrú, a ainmniú agus a aicmiú. Ba mhór an cuidiú san obair seo an tuiscint a tháinig chuig Dmitrí Meindeiléiv, John Newlands, agus Lothar Meyer timpeall na bliana 1870—is é sin, nuair a ordaíodh na dúile ceimiceacha de réir a meáchan adamhach, go raibh na saintréithe céanna á nochtadh go tráthrialta. D'oibrigh Meindiléiv amach an chéad tábla peiriadach, agus na dúile curtha taobh le chéile de réir a meáchan adamhach agus na saintréithe comhchosúla. Ó bhí an tábla seo mantach in áiteanna, bhí Meindiléiv ábalta tuairim a thabhairt i dtaobh na ndúl a bhí ag fanacht lena bhfionnachtain i gcónaí. Nuair a aonraíodh an chéad uair iad, fíoraíodh a chuid tairngreachtaí.
Fodhisciplíní na Ceimice
- An Cheimic Neamhorgánach: déanann an fodhisciplín seo taighde ar na comhdhúile neamhorgánacha, is é sin, na comhdhúile nach bhfuil slabhraí d'adaimh an charbóin iontu.
- An Cheimic Orgánach: Fadó, b'ionann an cheimic orgánach agus an bhithcheimic. Sa lá atá inniu ann, áfach, tugtar ceimic orgánach ar cheimic na gcomhdhúl carbónacha. Tá an carbón in ann slabhraí móra fada a dhéanamh nach bhfuil teorainn ná críoch leo, agus an dúrud de chomhdhúile éagsúla ann a bhfuil slabhraí den chineál sin iontu. is ábhar taighde ann féin, mar sin, na slabhraí seo agus na struchtúir éagsúla mhóilíneacha a gcuireann siad bun leo.
- An Bhithcheimic: Sin é an t-ainm a thugtar sa lá atá inniu ann ar cheimic na neacha beo agus ar an dóigh a n-úsáidtear coincheapa agus modhanna oibre na ceimice sa bhitheolaíocht.
- An Cheimic Fhisiceach: Shoiléirigh an mheicnic chandamach sa bhliain 1926, go raibh bunús fisice taobh thiar den cheimic. Go bunúsach, déanann an ceimiceoir fisiceach taighde ar an mbaint atá ag an gceimic leis an bhfisic. Mar shampla, is suim leis teirmidinimic na ceimice, cinéitic na n-imoibrithe ceimiceacha, an leictriceimic, an mheicnic staitisteach, agus an speictreascópacht. Is deacair an cheimic fhisiceach a aithint go soiléir ón bhfisic mhóilíneach. Tá gá ag an gceimiceoir fisiceach leis an gcalcalas agus é ag fréamhú a chuid cothromóidí. Baineann an cheimic fhisiceach go dlúth leis an gceimic theoiriciúil agus le ceimic an chandaim.
- An Cheimic Theoiriciúil: Is éard atá i gceist leis an gceimic theoiriciúil ná réasúnaíocht theoiriciúil na fisice agus na matamaitice a chuirtear i bhfeidhm ar cheisteanna na ceimice. Go háirithe, tugtar ceimic chandamach ar an dóigh a bhfeidhmítear an fhisic chandamach sa cheimic. Sna blianta i ndiaidh an Dara Cogadh Domhanda, chuaigh na ríomhairí an oiread sin i bhfeabhas gur féidir a rá go bhfuil a leithéid de bhrainse ann agus ceimic ríomhaireachta, is é sin, forbairt agus feidhmiú na ríomhchlár le freastal ar shainriachtanais na ceimice. Tá dlúthbhaint ag an gceimic theoiriciúil le fisic an damhna chomhdhlúite agus leis an bhfisic mhóilíneach. Níl i gceist go bunúsach leis an gceimic theoiriciúil ach fisic, ar an gcaoi chéanna nach bhfuil sa bhitheolaiocht theoiriciúil ach ceimic agus fisic.
- Is í an cheimic núicléach an brainse den cheimic a phléann leis an radaighníomhaíocht: an úsáid a bhaintear as an radaighníomhaíocht le taighde a dhéanamh ar ghnáth-imoibrithe ceimiceacha (radaiceimic), an tionchar atá ag mais na n-iseatóp éagsúil ar na himoibrithe ceimiceacha (ceimic iseatópach), agus speictreascópacht an athshondais mhaighnéadaigh núicléigh—is é sin, brainse speictreascópachta a théann i dtuilleamaí saintréithe maighnéadacha na núicléas le móilíní a aithint. Is féidir "ceimic núicléach" a thabhairt ar an dóigh a n-úsáideann fisiceoirí núicléacha modhanna oibre nó coincheapa na ceimice le taighde a dhéanamh ar eamhnú agus ar chomhleá na núicléas.
Brainsí eile de chuid na ceimice is ea: an réaltcheimic, an cheimic atmaisféarach, an innealtóireacht cheimiceach, an fhaisnéisíocht cheimiceach, an leictriceimic, ceimic an chomhshaoil, an cheimic shreabhach, an gheocheimic, an cheimic ghlas, stair na ceimice, eolaíocht na n-ábhar, ceimic na míochaine, an bhitheolaíocht mhóilíneach, an nanaitheicneolaíocht, an cheimic orgánaimhiotalach, an pheitriceimic, an chógaseolaíocht, an fhótaiceimic, an fhíticeimic, an cheimic pholaiméarach, an cheimic soladstaide, an tsonaiceimic, an cheimic fhormhóilíneach, an cheimic dhromchlach, agus an teirmiceimic.
Bun-choincheapa na ceimice
Ainmníocht
Tá córas dian ainmníochta in úsáid ag na ceimiceoirí a cheadaíonn dóibh ainm neamh-dhébhríoch a thabhairt ar gach comhdhúil cheimiceach. Mar shampla, i gcomhdhúile neamhorgánacha, cuirtear—íd le hainm na dúile is leictridhiúltaí.
NaCl = clóiríd sóidiam.
NO2 = dé-ocsaíd nítrigine. Anseo, is í an ocsaigin is leictridhiúltaí, agus dhá adamh ocsaigine ceangailte d'aon adamh nítrigine amháin—mar sin, tugaimid dé-ocsaíd nítrigine ar an gcomhdhúil seo.
SO3 = trí-ocsaíd sulfair. Anseo, arís, is í an ocsaigin is leictridhiúltaí, agus trí adamh ocsaigine ceangailte le gach adamh sulfair—trí-ocsaíd sulfair a thugtar ar an gcomhdhúil, mar sin.
OF2 = dé-fhluairíd ocsaigine. Is é an fluairín an t-aon dúil cheimiceach amháin a sháraíonn an ocsaigin maidir le leictridhiúltacht, agus mar sin tugaimid fluairíd ar an gceann seo.
In ainmníocht na n-ian coimpléascach, is gnách na lioganna a ainmniú ar dtús agus an t-adamh lárnach a ainmniú ina dhiaidh sin. Cuirtear ó fada i ndeireadh ainm na liogainne. Sa deireadh, tugtar uimhir ocsaídiúcháin an adaimh lárnaigh le fios idir lúibíní:
AuCl4- = ian teitreaclóró-óráite (III). Ian coimpléascach, nó "slánaonad comhordúcháin", is ea an teitreaclóróráit, ina bhfuil ceithre ian clóiríde ceanglaithe d'ian an óir a bhfuil an uimhir ocsaídiúcháin +3 aige. Mar sin, tugaimid "teitreaclóró-óráit (III)" ar an ian seo.
SO42- = ian teatrocsósulfáite (VI). Ar ndóigh, is é an gnáth-ian sulfáite é, ach is féidir an t-ainm córasach seo a thabhairt air freisin. Is í an uimhir ocsaídiúcháin atá ag an sulfar san ian áirithe seo ná +6, agus is iain ocsaíde iad na lioganna.
Adaimh
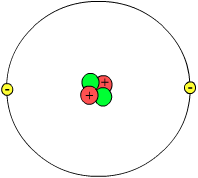
Ba é an Gréagach Democritos (t. 450 R. Ch.) a chéadchuir i bhfáth an teoraic go raibh na damhnaí uile déanta d'adaimh. De réir an fhealsaimh úd, ní féidir leanúint de roinnt damhna ar bith go síoraí, mar go dtiocfaí ar deireadh ar cháithníní nó mhionbhair den damhna nach bhféadfaí a roinnt níos mó. Ar cháithníní díobh sin, thug Democritos an t-ainm (Gréigis: άτομον, atmos (adamh), a chiallaíonn aonad do-roinnte. B'inmheasta dó go raibh na hadaimh an-mhion agus go raibh uimhir ollmhór díobh fiú sa ghiota ba lú de dhamhna a bhí sofheichte.
Go deimhin, bhí os cionn dha mhíle bliain le himeacht sula bhfuarthas fianaise thurgnamhach go raibh dúile déanta de na haonais bhunúsacha úd.
I ngach adamh tá núicléas faoina lucht deimhneach i lár baill agus, mórthimpeall air sin, leictreoin (nó leictreon) le lucht diúltach.
Dúile
Is éard is dúile ann ná substaintí nach féidir a dhianscaoileadh go ceimiceach ina substaintí eile níos simplí.
Tugtar substaintí íona ar shubstaintí nach meascáin iad. Is dúile nó comhdhúile iad substaintí íona.
Cuirtear na dúile seo taobh le taobh i dtábla a dtugtar an tábla peiriadach air.
Tá siombail ag gach dúil, mar shampla, H = hidrigin.
Ba é an t-eolaí Dmítrí Meindeiléiv a chuir an chéad bhun leis an tábla peiriadach seo sa bhliain 1869. Tá gach dúil atá ar eolas liostaithe i dtábla peiriadach na ndúl.
Iain
Is éard is ian ann ná adamh nó móilín a bhfuil lucht leictreach aige. Má dhéanann adamh nó móilín leictreon dá chuid a thabhairt uaidh, nó leictreon de chuid adaimh nó móilín eile a ghlacadh chuige, ní bheidh sé neodrach a thuilleadh. Beidh lucht leictreach aige—lucht diúltach, má fuair sé leictreon ar iasacht, lucht deimhneach, má thug sé ceann uaidh. Is dual don dá chineál lucht leictreach an cineál céanna a éaradh (a ruaigeadh uaidh) agus an cineál eile a aomadh (a tharraingt chuige). Ina lán comhdhúl ceimiceach, tá an dá chineál ian ann, agus iad curtha in aice a chéile sa chriostal ionas go bhfuil gach ian timpeallaithe ag iain den chineál eile. Mar sin, coinníonn an fórsa aomtha—an nasc ianach an criostal le chéile.
Bíonn na comhdhúile ianacha sothuaslagtha san uisce, toisc gur tuaslagóir polach é an t-uisce. Is é sin, tá pol diúltach agus pol deimhneach ag an móilín uisce - deirtear gur déphol é an móilín uiscec—é go bhfuil an móilín féin neodrach. Aomann an pol diúltach iain dheimhneacha, agus na hiain dhiúltacha ag tarraingt ar an bpol eile.
Sampla de chomhdhúil ianach é an gnáthshalann, is é sin, an chlóiríd sóidiam. Tá an salann an-difriúil leis an dá dhúil a bhfuil sé comhdhéanta as, mar atá, an clóirín agus an sóidiam. Gás buíghlas nó uaine é an clóirín a bhfuil boladh láidir as, agus nimh atá ann don duine, nó oibríonn sé go tubaisteach ar na scamhóga: níl tiúchan mór clóirín san aer análaithe de dhíth le héidéime scamhógach a tharraingt ar an duine, is é sin, na scamhóga a líonadh le sreabh nó leacht a thachtfaidh an t-othar (sin é an tuige, dála an scéil, gur baineadh úsáid as an gclóirín mar ghás cogaidh—arm ceimiceach—sa Chéad Chogadh Domhanda). Maidir leis an sóidiam, is miotal alcaileach é—is é sin, miotal bog atá chomh haraiciseach chun imoibriú a dhéanamh le substaintí eile is go rachaidh sé trí thine san uisce. Má chuirtear clóirín agus sóidiam in aice le chéile, imoibreoidh siad le chéile go fiáin fíochmhar le salann a dhéanamh. Tabharfaidh gach adamh sóidiam aon leictreon amháin ar iasacht do cheann de na hadaimh chlóirín, ionas go gcruthófar iain chlóiríde, Cl-, agus iain sóidiam, Na+.
Ní mór an t-alt seo a ghlanadh, ionas go mbeidh caighdeán níos fearr ann.
Tar éis duit an t-alt a ghlanadh, is féidir leat an teachtaireacht seo a bhaint de. Féach ar Conas Leathanach a Chur in Eagar agus an Lámhleabhar Stíle le fáil amach faoin dóigh cheart le feabhas a chur ar alt ciclipéide. |
Nuair a dhóitear an miotal sóidiam Na+ i ngás clóirín Cl− fabhraítear clóiríd sóidiam NaCl (náthshalann neodrach).
Bíonn cruthú naisc ianaigh nó aistriú iomlán leictreoin ó adamh sóidiam go hadamh clóirín i gceist san imibriú seo.
Comhdhúil
Is éard is comhdhúil ann ná aon substaint cheimiceach a chruthaítear de thoradh imoibriú ceimiceach ina n-aontaítear dhá dhúil éagsúla, nó níos mó, de réir comhshuíomh seasta idir na dúile.
Nuair a dhéantar comhdhúil as a chuid dúl, bíonn airíonna difriúla de ghnáth ag an gcomhdhúil le hais airíonna na ndúl as a ndearnadh é. Mar shampla, is solad bán é clóiríd sóidiam (salann coitianta) atá réasúnta neamhimoibríoch go ceimiceach. Is iad na dúile as a bhfuil sé déanta ná sóidiam, miotal airgid atá an-imoibríoch, agus clóirín, gás glas atá an-imoibríoch.
I gcomhdhúil cheimiceach, bíonn adaimh na ndúl éagsúil ceangailte lena chéile le naisc cheimiceacha—ianacha nó chomhfhiúsacha.
Cuirtear coibhneas na ndúl agus struchtúr inmheánach na comhdhúile in iúl le foirmlí éagsúla ceimiceacha. Is comhdhúil an t-uisce ina mbíonn hidrigin agus ocsigin i gcóimheas 2:1.
Tá an t-adamh ocsigin idir an dá adamh hidrigine, agus uillinn 104.45° eatarthu.

Mar shámpla, tugann an fhoirmle seo a leanas d'uisce (H2O) le fios dúinn go bhfuil uisce ina chomhdhúil agus go bhfuil dhá adamh hidrigine nasctha d'aon adamh ocsaigine amháin.
Níl comhdhúile liostaithe i dtábla peiriadach na ndúl.
Móilíní

Is éard is móilín ann ná an chuid is lú de dhúil nó de chomhdhúil is féidir a bheith ann go neamhspleách.
Tugtar ceimic mhóilíneach nó fisic mhóilíneach ar na heolaíochtaí a bhaineann leis an ábhar seo, ag brath ar chlaonadh an fhócais.
Substaint
Is éard atá i substaint ná dúil nó comhdhúil.
Nasc ceimiceach
Na fórsaí leictreacha a cheanglaíonn adaimh i móilíní agus pais sholadacha neamh-mhóilíneacha. In aon adamh, timpeallaíonn na leictreoin an núicléas i bhfithiseáin i sceallaí timpeall an núicléis. Muna mbíonn an sceall seachtrach lán le leictreoin, an uasmhéid atá ceadaithe don adamh sin, bíonn an t-adamh éagobhsaí agus fonn air nasc a dhéanamh le hadamh eile. Aithnítear 3 shaghas naisc phríomhúil. An nasc ianach, mar atá i gclóiríd sóidiam, NaCl (salann mín), inar chaill an sóidiam leictreon agus ar ghnóthaigh an clóirín leictreon, ionas go gcoinnítear na hiain seo le chéile trí aomadh frithpháirteach idir Na+ is Cl-. Sa nasc comhfhiúsach, mar atá i gclóirín, Cl2, bíonn cuid de na leictreoin bainteach leis an dá núicléas. Nuair a nascann dhá adamh hidrigine (H) le hadamh amhain ocsaigine (O), cruthaítear móilín uisce, H2O, agus bíonn dhá nasc chomhfhiúsacha ann. Sa nasc miotalach, mar atá i sóidiam, Na, bíonn na fiúsleictreoin dílogánaithe agus bainteach le cuid mhaith núicléas, rud a thugann seoltacht leictreach don mhiotal. Tugtar nasc singil ar nasc comhfhiúsach ina bhfuil dhá leictreon i gceist, nasc dúbalite ar cheann le 4 leictreon, agus nasc triarach ar cheann le 6 leictreon. Comharthaítear na naisc seo i bhfoirmlí ceimiceacha le -, =, is ≡. Tugtar an nascfhuinneamh ar an bhfuinneamh is gá chun nasc ceimiceach a bhriseadh (mar shampla, chun móilín clóirín, Cl2, a athrú in dhá adamh clóirín, 2 Cl).
Athruithe Staide
Tá an damhna uile comhdhéanta d'adaimh nó de mhóilíní agus braitheann an staid ina mbíonn siad ar fhuinneamh nó ar ghluaisne na gcáithníní (féach Teoiric Chinéiteach an Damhna).
Níl in athrú staide ach athruithe fisiceacha agus ní dhéantar aon substaint nua dá bharr.
Is athruithe fisiceacha amháin a thagann ar dhamhnaí sna cásanna seo a leanas: reo, leá, galú agus tuaslagadh. Cibé méid uaireanta a thagann athrú staide ar damhna íonghlan, ní chlaochlaítear é.
Bíonn na hathruithe staide seo inchúlaithe. I gcás an mhóilín H2O mar shampla, is féidir na hathruithe seo a léiriú mar seo a leanas:
Téigh Téigh
Oighear Uisce Gal
Fuaraigh Fuaraigh

Athruithe Ceimiceacha
In athruithe ceimiceacha, tagann athruithe bunúsacha i bhfeidhm a athraíonn damhnaí go damhnaí de ghné eile.
An Cheimic Chandamach
Thug an t-eolaí Max Planck Candaim ar na toirteanna fuinnimh a sheoltar ó adaimh. Bíonn radaíochtaí agus miníochtaí éagsúla ag cineálacha éagsúla adaimh agus bíonn méideanna éagsúla sna toirteanna fuinnimh a sheoltar uathu. Is brainse í an Cheimic Chandamach den cheimic theoiriciúil. Cuireann sí an Mheicnic Chandamach agus an Reimsetheoiric Chandamach i bhfeidhm ar cheisteanna agus ar fhadhbanna na ceimice.
Feidhm amháin den cheimic chadamach is ea iompraíocht leictreonach adaimh agus móilíní a thuairisciú i gcomhthéacs a n-imoibríochta.
Luíonn an Cheimic Chandamach ar an teorann idir an Cheimic agus an Fhisic agus tá inchur suntasach déanta ag eolaithe ón dá thaobh uirthi.
Dlíthe Ceimiceacha
Cinntíodh ó thurgnaimh a rinne Robert Boyle (1627–1691), Antoine-Laurent de Lavoisier agus John Dalton le linn an seachtú agus an t-ochtú aois déag go raibh damhnaí rialaithe ag dlíthe áirithe.
Is coincheap bunusach sa cheimic é Dlí Imchoimeád na Maise/an Damhna (nó Dlí Lomonosov-Lavoisier).
Is é rud a deir sé ná nach loitear agus nach gcruthaítear mais in athruithe fisiceacha nó ceimiceacha.
Mar sin, nuair a imoibríonn substaintí (nó imoibreáin) le chéile le substaintí (nó táirgí) nua a dhéanamh, is ionann mais iomlán na n-imoibreán agus mais iomlán na dtáirgí.
Cumainn Cheimiceacha
An Cheimic Idirphearsanta
Sanasaíocht
- Ailceimic na hÉigipte [5,000 BC – 400 BC], Leabharlann Chathair Alastair
- Ailceimic na Gréige [332 BC – 642 AD], na Greigigh i réim i gCathair Alastair
- Ailceimic na nArabach [642 AD – 1200], na hArabaigh i réim i gCathair Alastair, e.g. Is é Jabir an príomh-cheimiceoir.
- Ailceimic na hEorpa [1300 – Inniu], Gerber a thóg ar Cheimic na nArabach
- Ceimic [1661], Boyle The Sceptical Chemist
- Ceimic [1787], Lavoisier Élémentaire de Chimie
- Ceimic [1803], Dalton Atomic Theory
Féach freisin
- Fillteán Eolaíochta TS COGG http://www.cogg.ie/wp-content/uploads/ceimic-filltean-eolaiochta-ts.pdf
- CICLIPÉID EILE – ANOTHER UNFINISHED SCIENCE ENCYCLOPAEDIA IN IRISH, https://irishforenglishspeakers.blog/2017/04/10/ciclipeid-eile-another-unfinished-science-encyclopaedia-in-irish/
- Ceimiceoir agus Liosta ceimiceoirí
- Tábla peiriadach
- Liosta dúl de réir ainm
- (fr) Actualités Chimie, sur le site Futura-Sciences.com
- (fr) La chimie au lycée, sur le site du CNRS
- (en) Eric Weisstein's world of chemistry
- (fr) Vidéos participatives sur la chimie pour les élèves du secondaire
Leitheoireacht sa bhreis
- Atkins, P.W. Galileo's Finger (Oxford University Press)
- Chang, Raymond. Chemistry 6th ed. Boston: James M. Smith, 1998. ISBN 0-07-115221-0.
- MacCann, Diarmuid . Ceimic. An Chláir Nua don Mheánteistiméireacht. An Gúm 1985.
- Hussey, Matt. Nod don Eolach, Gasaitéar Eolaíochta.An Gúm 1999
- Kennedy, Porter, Scott. Eolaíocht Bhunúsach. An Gúm 1990.
- Pauling, L. The Nature of the chemical bond (Cornell University Press) ISBN 0-8014-0333-2
- Pauling, L., and Wilson, E. B. Introduction to Quantum Mechanics with Applications to Chemistry (Dover Publications) ISBN 0-486-64871-0
- Pauling, L. General Chemistry (Dover Publications) ISBN 0-486-65622-5
Liosta léitheoireachta do mhicléinn ollscoile
- Atkins,P.W. Physical Chemistry (Oxford University Press) ISBN 0-19-879285-9
- Atkins,P.W. et al. Molecular Quantum Mechanics (Oxford University Press)
- Ó Cinnéide, Seán. Ceimic Bhunúsach 1. An Chéad Chló, Rialtas na hÉireann.
- McWeeny, R. Coulson's Valence (Oxford Science Publications) ISBN 0-19-855144-4
- Stephenson, G. Mathematical Methods for Science Students (Longman)ISBN 0-582-44416-0
- Smart and Moore Solid State Chemistry: An Introduction (Chapman and Hall) ISBN 0-412-40040-5
- Atkins,P.W., Overton,T., Rourke,J., Weller,M. and Armstrong,F. Shriver and Atkins inorganic chemistry (4th edition) 2006 (Oxford University Press) ISBN 0-19-926463-5
- Clayden,J., Greeves,N., Warren,S., Wothers,P. Organic Chemistry 2000 (Oxford University Press) ISBN 0-19-850346-6
- Voet and Voet Biochemistry (Wiley) ISBN 0-471-58651-X
Naisc Sheachtracha
- MIT OpenCourseWare | Chemistry
- EuroChem (European Portal for Chemistry - Database of Hazard Compounds, European Legislation)
- Chemistry Information Database
- Chemistry Research
- International Union of Pure and Applied Chemistry
- IUPAC Nomenclature Home Page, see especially the "Gold Book" containing definitions of standard chemical terms
- Material safety data sheets for a variety of chemicals
- Cook/Douglass Multimedia Achives contains videos of General Chemistry tutorials; worked out example problems
- BestChoice Stage 1 University Chemistry tutorial from University of Auckland

