Ocsaíd

Is éard is ocsaíd ann ná comhdhúil cheimiceach ina mbíonn ar a laghad adamh ocsaigine amháin agus dúil eile amháin aici ina fhoirmle cheimiceach. Bíonn, de ghnáth, ainian d'ocsaigine sa stát ocsaídiúcháin -2 sna ocsaídí miotail. Tá an chuid is mó de screamh an Domhain comhdhéanta de ocsaídí soladacha, de thoradh ar na heilimintí a bheith ocsaídithe ag an ocsaigin san aer nó san uisce. Táirgeann dócháin hidreacarbóin an dá phríomh-ocsaídí, aonocsaíd charbóin agus dé-ocsaíd charbóin. Fiú ábhair a mheastar mar íoneilimintí, go minic, forbraíonn siad bratú ocsaíde. Mar shampla, forbraíonn scragall alúmanaim craiceann tanaí de Al2O3 a chosnaíonn an scragall ó chreimeadh breise.
Foirmiú[cuir in eagar | athraigh foinse]
Mar gheall ar a leictridhiúltachta, cumann ocsaigin nascanna cobhsaí ceimiceacha le beagnach gach dúil chun ocsaídí comhfhreagracha a chruthú. Bíonn tóir ar na thriathmhiotail (mar shampla, ór nó platanam) toisc go fhriotaíonn siad cuingriú ceimiceach díreach le hocsaigin, agus bíonn ar shubstaintí cosúil le ocsaíd óir (III) a bheith ginte trí bhealaí indíreacha.
Tá dhá chosán neamhspleách ann maidir le creimeadh na n-eilimintí, mar atá hidrealú agus ocsaídiú le hocsaigin. Bíonn an meascán 'le huisce agus le hocsaigin' níos creimní fós. Dónn na heilimintí go léir beagnach in atmaisféar ocsaigine, nó i dtimpeallacht atá ocsaigin saibhir. I láthreacht uisce agus ocsaigin (nó go simplí aer), imoibríonn roinnt eilimintí go tapa, nó fiú go baolach, chun hiodrocsaídí a thabhairt, m.sh. sóidiam. I bpáirt, mar gheall ar ar an gcúis seo, ní fhaightear alcailí nó miotail cré-alcaileacha sa dúlra i riocht miotalach ie, foirm nádúrtha,. Tá Caeisiam chomh imoibríoch sin le hocsaigin go n-úsáidtear é mar fhaighteoir i bhfolúsfheadáin, agus úsáidtear tuaslagáin de photaisiam agus sóidiam, NaK mar a thugtar orthu, chun roinnt tuaslagóirí orgánacha a dhí-ocsaiginiú agus a dhíhiodráitiú. Is éard a bhíonn ar dhromchla miotail de ghnáth ná ocsaídí agus hiodrocsaídí i láthair an aeir. Is sampla aithnidiúil é scragall alúmanaim, atá brataithe le scannán tanaí de ocsaíd alúmanaim a éighníomhaíonn am miotal, a mhoillíonn an próiseas creimthe. Is féidir tiús níos a chur leis an chiseal ocsaíd alúmanaim tríd an bpróiseas anóidithe leictrealaíodh. Cé go n-imoibríonn maignéisiam agus alúmanaim go mall le hocsaigin ag teocht agus brú caighdeánach (TBC) -cosúil le a lán miotail eile, dónn siad san aer agus gineann siad teocht an-ard. Is féidir le púdair mhínsnáitheach den chuid is mó miotal a bheith contúirteach pléascach san aer. Dá bhrí sin, úsáidtear iad go minic i roicéid le breosla soladach.
San ocsaigin thirim, táirgíonn iarann ocsaíd iarainn (II) go héasca, ach is gnách go mbíonn ocsaigin agus uisce ag teastáil le haghaidh foirmiú na n-ocsaídí fheireacha hiodráitithe, Fe2O3−2x(OH)x, a chuimsíonn mórchuid na meirge. Tháirg baictéir fótaisintéiseacha ocsaigin saor in aisce roinnt 3.5 billiún bliain ó shin agus dá bhrí sin deascadh iarann as tuaslagán san aigéan mar Fe2O3 san iarann tábhacht eacnamaíoch haemaitít.
Struchtúr[cuir in eagar | athraigh foinse]
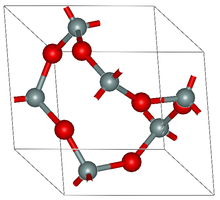
Glacann formhór ocsaídí na miotal struchtúir polaiméireacha le trasnaisc M-O-M. Toisc go bhfuil na trasnaisc láidir, is gnách go mbíonn na solaid dothuaslagtha i dtuaslagóirí, cé gur féidir leo bheith faoi ionsaí ag aigéid agus ag bunanna. Bíonn na foirmlí go minic simplí, ach go míthreorach. Tá go leor dóibh ina gcomhdhúile neamh-stoichiometrica. Sna ocsaídí seo, bíonn an uimhir chomhordúcháin na liogainne ocsaíde 'a dó' le haghaidh eilimintí leictridhiúltacha agus 3-6 don chuid is mó de na miotail.
Ócsaídí Móilíneacha[cuir in eagar | athraigh foinse]

Cé go bhfuil an chuid is mó de na hocsaídí miotail polaiméireach, is móilíní iad roinnt ocsaídí. Is iad na hocsaídí móilíneacha is cáiliúla ná dé-ocsaíd charbóin agus aonocsaíd charbóin. Is ocsaíd mhóilíneach níos casta í peantocsaíd fhosfair, le hainm gur chúis mheabhlaithe é, leis an fhoirmle P4O10. Nuair a théitear roinnt ocsaíd pholaiméireach bíonn siad dípholaiméirithe agus faightear móilíní, is samplaí iad dé-ocsaíd seiléiniam agus trí-ocsaíd sulfair. Bíonn na teatrocsaídí neamhchoitianta, is í teatrocsaíd oismiam sampla amháin díobh.] Tá go leor ocsainian ar eolas againn, ar nós polafosfáití agus polaocsamhiotaláiteanna. Is annamh a bhíonn na hocsacaitiain ar fáil, mar shampla nítreasonium (NO +). Ar ndóigh, tá a lán comhdhúl ar eolas againn leis an dá hocsaídí agus grúpaí eile freisin. Sa cheimic orgánach, cuimsíonn siad seo na céatóin agus go leor comhdhúl carbóinil a bhaineann leo. Sna miotail trasdultacha, bíonn go leor ocsó-coimpléisc ar eolas againn chomh maith le hocsóhailíd.
