Eistear

Is éard is eistear ann ná comhdhúil cheimiceach atá díorthaithe ó aigéad (orgánach nó neamhorgánach), ina gcuirtear grúpa –O–ailcile (alcocsa) in ionad ghrúpa hiodrocsaile amháin -OH, mar atá san imoibriú malartaíochta d'alcóil le haigéad carbocsaileach. Mar shampla, faightear aicéatáit eitile is uisce, mar seo: CH3CH2OH (eatánól) + CH3COOH (aigéad aicéiteach) → CH3COOHCH2CH3 (aicéatáit eitile)+ H2O (uisce).
Is eistir d'aigéid shailleacha de ghliocról iad na glicrídí; tá siad tábhachtach sa bhitheolaíocht, toisc go bhfuil siad ar cheann de na príomh-aicmí lipidí agus go bhfuil siad sa chuid is mó de shaillte ainmhithe agus d'olaí glasraí.
De ghnáth bíonn boladh deas ag na heistir; úsáidtear iad siúd a bhfuil meáchan móilíneach íseal acu go coitianta mar cumhráin agus tá siad le fáil i mblátholaí agus fearamóin. Feidhmíonn siad mar thuaslagóirí ardghráid le haghaidh réimse leathan plaistigh, plaisteachán, roisíní agus laicear, agus tá siad ar cheann de na haicmí bithbhealaí sintéiseacha is mó ar an margadh tráchtála. Is plaistigh thábhachtacha iad na poileistir, le monaiméirí ceangailte ag cineálacha eistir. Cnámh droma na móilíní ADN is ea na foisfeistir. Bíonn na heistir níotráite, mar nítriglicrín, ar eolas mar gheall ar a n-airíonna pléascacha.
Ainmnítear na heistir mar a bheadh salainn iontu, an chéad chuid ón aigéad is an dara cuid ón alcól. Bíonn boladh sainiúil toraidh as na heistir shimplí. Boladh piorraí atá as aicéatáit eitile, ar tuaslagóir tábhachtach é. Maidir le holaí is saill glasraí is ainmhithe, is eistir gliocróil den chuid is mó iad.
Ainmníocht
[cuir in eagar | athraigh foinse]Sanasaíocht
[cuir in eagar | athraigh foinse]Ba é an ceimiceoir Gearmánach Leopold Gmelin a chum an focal eistear (Gearmáinis: ester) sa bhliain 1848, is dócha mar ghiorrúchán den fhocal Essigäther, sa Ghearmánais, (Gaeilge: Aicéatáit eitile).
Ainmníocht AIGCF
[cuir in eagar | athraigh foinse]Díorthaítear ainmneacha ón máthair-alcól agus ón máthair-aigéad, áit a bhféadfadh an dara ceann a bheith orgánach nó neamhorgánach. Is gnách go n-ainmnítear na heistir a dhíorthaítear ó na haigéid charbocsaileacha is simplí de réir na "n-ainmneacha fánacha" níos traidisiúnta, mar a thugtar orthu .i. mar formáit, aicéatáit, própánáit, agus bútaráit, seachas ainmníocht AIGCF; meatánóáit, eatánóáit, própánóáit, agus bútánóáit. Ar an láimh eile, is minic a ainmnítear eistir a dhíorthaítear ó aigéid charbocsaileacha níos casta agus keas a bhaint as an t-ainm córasach AIGCF, bunaithe ar ainm an aigéid agus an iarmhír -óáit ina dhiaidh sin. Mar shampla, tá an fhoirmle CH3(CH2)6CO2(CH2)5CH3 ag an eistear ochtánóáit heicsile, ar a dtugtar freisin faoin ainm fánach caprailáit heicsile.
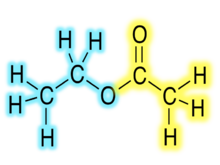
Is gnách go mbíonn foirmlí ceimiceacha eistir orgánacha i bhfoirm RCO2R′, áit arb iad R agus R ′ na codanna hidreacarbóin den aigéad carbocsaileach agus an alcól, faoi seach. Mar shampla, scríobhfaí aicéatáit bhúitile (eatánóáit bhúitile go córasach), a dhíorthaítear ó bhútánól agus aigéad aicéiteach (aigéad eatánóch go córasach) CH3CO2C4H9.. Tá cur i láthair malartach coitianta lena n-áirítear BuOAc agus CH3COOC4H9. Tugtar lachtóin ar eistir fháinneacha, is cuma má dhíorthaítear iad ó aigéad orgánach nó neamhorgánach. Sampla amháin de lachtón orgánach is ea γ-vailéaralachtón.
Ortai-eistir
[cuir in eagar | athraigh foinse]Aicme neamhchoitianta de chuid na n-eistear orgánach is ea na ortaieistir, a bhfuil an fhoirmle RC(OR′)3 acu. Díorthaítear ortaformáit tríeitile (HC(OC2H5)3), i dtéarmaí a ainm (ach ní a shintéis) ón aigéad ortaformach (HC(OH)3) agus eatánól.
Eistir neamhorgánacha
[cuir in eagar | athraigh foinse]
Is féidir eistir a dhíorthú freisin ó aigéid neamhorgánacha.
- Cruthaíonn an t-aigéad fosfarach orgánafosfáití (nó eistir fosfáite),.i. fosfáit trífheinile.
- Cruthaíonn an t-aigéad sulfarach orgánasulfáití (nó eistir sulfáite), .i. sulfáit démheitile.
- Cruthaíonn an t-aigéad nítreach eistir níotráite, .i. níotráit mheitile
- Cruthaíonn an t-aigéad bórach bóráití, .i. bóráit trímheitile
- Cruthaíonn an t-aigéad carbónach eistir charbónáite, .i. carbónáit eitiléine
Cruthaíonn aigéid neamhorgánacha, atá ann mar tátaiméirí, eistir éagsúla
- Cruthaíonn an t-aigéad fosfarach dhá chineál eistear foisfíte, .i. foisfít trímheitile (P(OEt)3) agus foisfít demheitile (HP(O)(OEt)2).
Cruthaíonn aigéid neamhorgánacha atá éagobhsaí nó ar deacair teacht orthu eistir chobhsaí.
- Cruthaíonn an t-aigéad crómach, nár braitheadh air riamh, di-tert-butyl chromate
- Cruthaíonn an t-aigéad sulfarach, atá annamh, sulfít démheitile.
I bprionsabal, d’fhéadfaí gach alcocsaíd mhiotail agus mhiotalóideach, a bhfuil na céadta ar eolas fúthu, a aicmiú mar eistir de na haigéid theoiriciúla.
Struchtúr agus nascadh
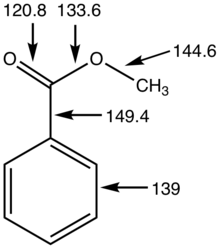
[cuir in eagar | athraigh foinse]Bíonn lárionad carbóinile sna heistir, as a dtagann uillinneacha 120 ° C - C - O agus O - C - O. Murab ionann agus aimídí, is feidhmghrúpaí solúbtha ó thaobh struchtúir iad eistir toisc go bhfuil bacainn íseal mar gheall ar rothlú thart timpeall ar na naisc C-O-C. Bíonn a solúbthacht agus a bpolaraíocht íseal le feiceáil ina n-airíonna fisiciúla; is iondúil nach mbíonn siad chomh docht (leáphointe níos ísle) agus níos so-ghalaithe (fiuchphointe níos ísle) ná na haimídí comhfhreagracha. Tá pKa na n-alfa-hidriginí ar na heistir thart ar 25.
Tá an poitéinseal ag go leor eistir isiméireacht chonformálach a dhéanamh, ach is iondúil go nglacann siad conformáil s-cis (nó Z) seachas an treo malartach s-trasach (nó E), mar gheall ar chuingir d’éifeachtaí hipear-chomhchuingithe agus dépholacha íoslaghdaithe. Bíonn tionchar ag nádúr na n-ionadán agus an tuaslagóra ar an rogha maidir le comhfhoirmiú Z, má tá sé ann. Tá lachtóin le fáinní beaga teoranta don chonformáil s-trasach (.i. E) mar gheall ar a struchtúr fáinneach.

Airíonna fisiceacha agus saintréithriú
[cuir in eagar | athraigh foinse]Bíonn eistir níos polaí ná éitir ach níos lú ná alcóil. Glacann siad páirt i naisc hidrigine mar ghlacóirí nasc-hidrigine, ach ní féidir leo gníomhú mar dheontóirí nasc- hidrigine, murab ionann agus a máthair-alcóil. Tugann an cumas seo chun páirt a ghlacadh i nascadh hidrigine roinnt intuaslagthacht uisce orthu. Mar gheall ar a n-easpa cumais chun nasc hidrigine a dheonadh, ní bhíonn eistir in ann féin-chomhthiomsú. Dá bhrí sin, tá eistir níos so-ghalaithe ná aigéid charbocsaileacha a bhfuil meáchan móilíneach den chineál céanna acu.[2]
Saintréithriú agus anailís
[cuir in eagar | athraigh foinse]De ghnáth sainaithnítear eistir trí chrómatagrafaíocht gháis, agus leas á bhaint as a so-ghalaitheacht.
Naisc sheachtracha
[cuir in eagar | athraigh foinse]Tagairtí
[cuir in eagar | athraigh foinse]- ↑ A. A. Yakovenko, J. H. Gallegos, M. Yu. Antipin, A. Masunov, T. V. Timofeeva (2011). "Crystal Morphology as an Evidence of Supramolecular Organization in Adducts of 1,2-Bis(chloromercurio)tetrafluorobenzene with Organic Esters". Cryst. Growth Des. 11 (9): 3964–3978. doi:10.1021/cg200547k.
- ↑ March, J. Advanced Organic Chemistry 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.
