Stócaiméadracht
Sa cheimic, is éard is stócaiméadracht ann ná ríomh na n-imoibreán agus na dtáirgí in imoibrithe ceimiceacha .
Tá an stócaiméadracht bunaithe ar Dhlí Imchoimeád na Maise. De réir an dlí seo, ní loitear na ní chruthaítear mais in athruithe fisiceacha no ceimiceacha. Bíonn mais iomlán na n-imoibreán cothrom le mais iomlán na dtáirgí, rud a fhágann go mbíonn an caidreamh idir cainníochtaí imoibreán agus táirgí de ghnáth mar chóimheas de shlánuimhreacha dearfacha. Ciallaíonn sé seo más eol méideanna na n-imoibreán ar leithligh, is féidir méid an táirge a ríomh. Os a choinne sin, má tá cainníocht aitheanta ag imoibreán amháin agus más féidir cainníocht na dtáirgí a chinneadh go heimpíreach, is féidir méid na n-imoibreán eile a ríomh freisin.
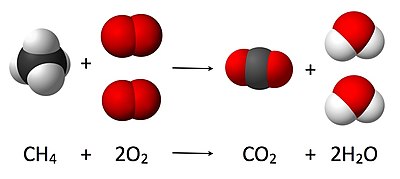
Taispeántar é seo san íomhá anseo, áit a bhfuil an chothromóid chothromaithe:
Anseo, imoibríonn móilín meatáin amháin le dhá mhóilín de ghás ocsaigine chun móilín amháin dé-ocsaíd charbóin agus dhá mhóilín uisce a thabhairt. Is sampla é an chothromóid cheimiceach áirithe seo de dhóchán iomlán. Tomhaiseann an stócaiméadracht na caidrimh chainníochtúla seo, agus úsáidtear í chun méid na dtáirgí agus na n-imoibreán a tháirgtear nó a theastaíonn in imoibriú ar leith a chinneadh. Tugtar stócaiméadracht imoibrithe ar na caidrimh chainníochtúla i measc dúl agus iad ag glacadh páirte in imoibrithe ceimiceacha. Sa sampla thuas, tomhaiseann stócaiméadracht imoibriúcháin an gaol idir na cainníochtaí meatáin agus ocsaigine a imoibríonn le dé-ocsaíd charbóin agus uisce a dhéanamh.
Mar gheall ar an ngaol atá ar eolas ag móil le meáchain adamhacha, is féidir na cóimheasa a thug an stócaiméadracht faoi deara a úsáid chun cainníochtaí a chinneadh de réir meáchain san imoibriú a thuairiscítear le cothromóid chothromaithe. Tugtar stócaiméadrachtchomhshuímh air seo.
Pléann gás-stócaiméadracht le himoibrithe a bhaineann le gáis, áit a bhfuil na gáis ag teocht, brú agus toirt aitheanta agus inar féidir glacadh leis gur gháis idéalacha iad. Maidir le gáis, go hidéalach tá an cóimheas toirte mar an gcéanna le dlí an gháis idéalaigh, ach caithfear cóimheas maise an imoibrithe aonair a ríomh ó mhaiseanna móilíneacha na n-imoibreán agus na dtáirgí. Go praiticiúil, mar gheall ar iseatóip a bheith ann, úsáidtear maiseanna mólaracha ina ionad agus an cóimheas maise á ríomh.
Sanasaíocht[cuir in eagar | athraigh foinse]
D'úsáid Jeremias Benjamin Richter an téarma stöchiometrie den chéad uair i 1792 nuair a foilsíodh an chéad imleabhar 'Anfangsgründe der Stöchyometrie [1] (nó i nGaeilge;Tús na stócaiméadrachta.) Tagann an téarma ó na focail Sean-Ghréigise στοιχεῖον (stoicheion) "dúil" agus μέτρον (metron) "tomhas". Sa Ghréigis phátrúnach, d’úsáid Nicephorus an focal Stoichiometria chun tagairt a dhéanamh do líon na líne a chomhaireamh sa Tiomna Nua canónach agus do chuid den Apocrypha.
Sainmhíniú[cuir in eagar | athraigh foinse]
Is é méid stócaiméadrachta nó cóimheas stócaiméadracha an imoibrí ná an méid nó an cóimheas is fearr más féidir, ag glacadh leis go dtéann an t-imoibriú ar aghaidh go dtí go gcríochnófar é:
- Ídítear an t-imoibrí ar fad
- Níl aon easnamh ar an imoibrí
- Níl barraíocht imoibrí ann.
Braitheann an stócaiméadracht ar na dlíthe an-bhunúsacha a chabhraíonn lena thuiscint níos fearr, .i. dlí imchoimeád na maise, an dlí an chomhshuímh thairisigh (ie, an dlí comhdhéanamh seasmhach), an dlí na gcomhréir iolrach agus dlí na gcomhréir deilíneach. Go ginearálta, comhcheanglaíonn imoibrithe ceimiceacha i gcóimheasa cinnte ceimiceán. Ós rud é nach féidir le himoibrithe ceimiceacha damhna a chruthú ná a scriosadh, ná dúil amháin a athrú go ceann eile, caithfidh méid gach dúile a bheith mar an gcéanna le linn an imoibrithe iomláin. Mar shampla, caithfidh líon na n-adamh i ndúil áirithe X ar thaobh an imoibreáin a bheith comhionann le líon na n-adamh san dúil sin ar thaobh an táirge, cibé an bhfuil na hadaimh sin go léir páirteach in imoibriú nó nach bhfuil.
Is éard atá in imoibrithe ceimiceacha ann, mar oibríochtaí aonaid mhacrascópaigh, ná líon an-mhór d’bhunimoibriúcháin, nuair a imoibríonn móilín amháin le móilín eile. Toisc gurb éard atá sna móilíní imoibriúcháin (nó páirteanna) tacar cinnte adamh i gcóimheas slánuimhir, tá an cóimheas idir imoibreáin in imoibriú iomlán i gcóimheas slánuimhir freisin. Féadfaidh imoibriú níos mó ná móilín amháin a idiú, agus comhaireann an uimhir stócaiméadrachta an uimhir seo, arna sainmhíniú mar dearfach do tháirgí (suimithe) agus diúltach d'imoibreáin (bainte). De ghnáth, tugtar na comhéifeachtaí stócaiméadrachta ar na comhéifeachtaí gan sín. Bíonn mais adamhach dhifriúil ag dúile éagsúla, agus mar bhailiúcháin d’adamh aonair, tá mais mhólarach cinnte ag móilíní, arna thomhas leis an aonadmhól (6.02 × 1023 móilín aonair, tairiseach Avogadro). De réir sainmhínithe, tá mais mhólarach 12 g / mól ag carbón-12. Mar sin, chun na stócaiméadrachta a ríomh de réir maise, cuirtear líon na móilíní atá riachtanach do gach imoibreán in iúl i móil agus iolraítear iad faoi mhais mhólarach gach ceann acu chun maise gach imoibreáin, in aghaidh mhóil an imoibrithe, a thabhairt. Is féidir na cóimheasa maise a ríomh trí gach ceann a roinnt ar an iomlán san imoibriú iomlán.
Is meascáin d'iseatóip a mbíonn an uimhir adamhach chéanna ag baint leo, ach mais-uimhir dhiftiúil, is ea dúile ina staid nádúrtha, dá bhrí sin ní slánuimhreacha iad maiseanna adamhacha. Mar shampla, in ionad comhréir chruinn chothrom 14:3, is éard atá i 17.04 kg d’amóinia ná 14.01 kg de nítrigin agus 3 × 1.01 kg de hidrigin, toisc go bhfuil nítrigin-15 san áireamh i nítrigin nádúrtha, agus folaíonn hidrigin nádúrtha hidrigin-2 (deoitéiriam).
Is imoibreán stócaiméadrach imoibreán a ídítear in imoibriú, seachas imoibreán catalaíoch, nach gcaitear san imoibriú iomlán toisc go n-imoibríonn sé i gcéim amháin agus go ndéantar é a athghiniúint i gcéim eile.
Gram a thiontú go móil[cuir in eagar | athraigh foinse]
Ní amháin go n-úsáidtear an stócaiméadracht chun cothromóidí ceimiceacha a chothromú ach úsáidtear í freisin i dtiontuithe, .i. graim a thiontú go móil ag úsáid mais mhólarach mar fhachtóir tiontaithe, nó ó ghraim go millilítear ag úsáid dlús. Mar shampla, chun méid de NaCl (clóiríd sóidiam) a fháil i 2.00 & nbsp; g, dhéanfadh duine an méid seo a leanas:
Sa sampla thuas, nuair a dhéantar iad a scríobh amach i bhfoirm chodáin, cruthaíonn na haonaid gram céannacht iolraíoch, atá comhionann le ceann amháin (g/g = 1), agus an méid mar thoradh air sin i móil (an t-aonad a bhí ag teastáil), mar a thaispeántar sa chothromóid seo a leanas;
Comhréir mhólarach[cuir in eagar | athraigh foinse]
Is minic a úsáidtear an stócaiméadracht chun cothromóidí ceimiceacha a chothromú (stócaiméadracht imoibriúcháin). Mar shampla, is féidir an dá ghás dé-adamhach, hidrigin agus ocsaigin, a chur le chéile chun leacht, uisce, a fhoirmiú in imoibriú eisiteirmeach, mar a thuairiscítear sa chothromóid seo a leanas:
2 H2 + O2 → 2 H2O
Déanann an stócaiméadracht imoibriúcháin cur síos ar an gcóimheas 2:1:2 de mhóilíní hidrigine, ocsaigine agus uisce sa chothromóid thuas.
Ceadaíonn an cóimheas mólarach tiontú idir móil de shubstaint amháin agus móil de shubstaint eile. Mar shampla, san imoibriú; 2 CH3OH + 3 O2 → 2 CO 2 + 4 H2 O
faightear an méid uisce a tháirgfear trí 0.27 mól de CH3OH a dhó, trí úsáid a bhaint as an gcóimheas mólarach idir CH3OH agus H2O de 2 go 4.
Méid an táirge a chinneadh[cuir in eagar | athraigh foinse]
Is féidir an stócaiméadracht a úsáid freisin chun cainníocht a tháirgeann imoibriú a fháil. Dá gcuirfí píosa copair (Cu) sholadaigh le tuaslagán uiscí de níotráit airgid (AgNO 3 ), dhéanfaí an t-airgead (Ag) a athsholáthar in imoibriú díláithrithe amháin ag foirmiú níotráit chopair uiscí (II) (Cu (NO3) 2) agus airgead soladach. Cé mhéad airgid a tháirgtear má chuirtear 16.00 gram de Cu leis an tuaslagán de níotráit airgid iomarcach?
D'úsáidfí na céimeanna seo a leanas:
- Scríobh agus cothromaigh an chothromóid
- Mais go móil: Tiontaigh gram de Cu go móil Cu
- Cóimheas móil: Tiontaigh móil Cu go móil de Ag a tháirgtear
- Mól go mais: Tiontaigh móil de Ag go graim de Ag a tháirgtear
Seo a leanas an chothromóid chothromaithe go hiomlán:
- Cu + 2AgNO3 → Cu(NO3)2 + 2 Ag
Chun na céime mais go mól a bhaint amach, dhéanfaí mais an chopair (16.00 g) a thiontú go móil chopair trí mhais an chopair a roinnt ar a mhais mhóilíneach: 63.55 g/ mól.
Anois ó fuarthas an méid Cu i móil (0.2518), is féidir linn cóimheas an mhóil a aimsiú. Faightear é seo trí bhreathnú ar na comhéifeachtaí sa chothromóid chothromaithe: tá Cu agus Ag i gcóimheas 1:2:
Anois gur eol gurb é 0.5036 mól na móil Ag a tháirgtear, déanaimid an méid seo a thiontú go gram Ag a tháirgtear chun teacht ar an bhfreagra deiridh:
Is féidir an tsraith áireamh a chomhdhlúthú tuilleadh in aon chéim amháin:
Samplaí breise[cuir in eagar | athraigh foinse]
Maidir le própán (C3H8) ag imoibriú le gás ocsaigine (O2), seo a leanas an chothromóid cheimiceach chothromaithe :
Ansin déantar mais an uisce a fhoirmítear má dhóitear 120 g de phrópán (C3 H8) i mbarraíocht ocsaigine
Naisc sheachtracha[cuir in eagar | athraigh foinse]
- Ceist fhada stócaiméadracht-2. https://www.youtube.com/watch?v=2BhpQlSqDB8
Tagairtí[cuir in eagar | athraigh foinse]
- ↑ "Anfangsgründe der Stöchyometrie … (in 3 vol.s)" (as de) (1792) vol. 1. Breslau and Hirschberg, (Germany): Johann Friedrich Korn der Aeltere. From p. 121: "Die Stöchyometrie (Stöchyometria) ist die Wissenschaft die quantitativen oder Massenverhältnisse … zu messen, in welchen die chemischen Elemente … gegen einander stehen." (Stoichiometry (stoichiometria) is the science of measuring the quantitative or mass relations in which the chemical "elements" exist in relation to each other.) [Note: On pp. 3–7, Richter explains that an "element" is a pure substance, and that a "chemical element" (chymisches Element (Elementum chymicum)) is a substance that cannot be resolved into dissimilar substances by known physical or chemical means. Thus, for example, aluminium oxide was a "chemical element" because in Richter's time, it couldn't be resolved further into its component elements.]










