Dé-ocsaíd sulfair
 | |
| Substaint cheimiceach | aicme eintiteas ceimiceach |
|---|---|
| Mais mhóilíneach | 63.962 Da |
| Tacsón ina n-aimsítear é | |
| Ról | truailleán aeir |
| Struchtúr ceimiceach | |
| Foirmle cheimiceach | SO₂ |
 | |
| SMILES canónta | Model 2D O=S=O |
| InChI | Model 3D |
| Airí | |
| Dlús | 0.002927 g/cm³ (a 0 °C, gás) |
| Luas forleata fuaime | 213 m/s (0 °C, gás) |
| Tuaslagthacht | 10 g/100 g (uisce, 20 °C) |
| Móimint leictreach dhépholach | 1.633 D |
| Pointe leáite | −76 °C −75.5 °C |
| Fiuchphointe | −10 °C (a 760 Torr) −10.05 °C (a 101.325 kPa) |
| Eantrópach mólarach caighdeánach | 248.2 J/(mol K) |
| Móimint leictreach dhépholach | 1.633 D |
| Eantalpacht chaighdeánach an fhoirmithe | −296.9 kJ/mol |
| Galbhrú | 3.2 atm (a 20 °C) |
| Guais | |
| Meánteorainn nochta ualaithe ama | 5 mg/m³ (10 h, luach ar iarraidh) 13 mg/m³ (8 h, Stáit Aontaithe Mheiriceá) |
| Short-term exposure limit (en) | 13 mg/m³ (luach ar iarraidh) |
| Láithreach contúirteach don bheatha nó sláinte | 262 mg/m³ |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
| Eile | |
| searbhas | |
Is comhdhúil cheimiceach í Dé-ocsaíd sulfair. Ag atmaisféar caighdeánach, is gás tocsaineach é le boladh géar greannach. Is é a tríphointe ná 197.69 K agus 1.67 kPa. Scaoiltear amach í go nádúrtha le linn gníomhaíochta bolcánacha.
Bhain na Rómhánaigh úsáid as dé-ocsaíd sulfair chun fíon a dhéanamh nuair a fuair siad amach nuair a dhóití coinnle sulfair taobh istigh de soithí folamh fíona go gcoimeádtar iad saor ó bholadh fhínéagair.[1]
Struchtúr agus nascadh
[cuir in eagar | athraigh foinse]Is móilín lúbtha é SO2 le C2v grúpa pointí siméadrach. Chuirfeadh chur chuige bunaithe ar teoiric an fhiúsnaisc, ag scrúdú ar s agus p fithiseáin amháin, síos ar an nascadh i dtéarmaí athshondais idir dhá struchtúr athshondas.
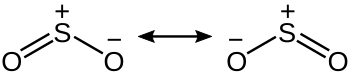
Tá nascord de 1.5 ag an nasc idir sulfair agus ocsaigin. Tugtar tacaíocht don chur chuige simplí seo nach n-agraíonn rannpháirtíocht d ' ' fithiseach.
Maidir le foirmiúlachas leictreonchomhairimh, tá staid ocsaídiúcháin de +4 ag adamh sulfair agus lucht foirmiúil de +1.[2]
Tarlú
[cuir in eagar | athraigh foinse]Bíonn SO2 le fáil ar an Domhan ach i dtiúchan an-bheag agus san atmaisféar ag thart ar 1 csb (codanna sa billiún).
Ar phláinéid eile, is féidir teacht uirthi i dtiúchain éagsúla, an ceann is tábhachtaí ná ar atmaisféar Véineas, áit a bhfuil sí ar an an tríú gás is suntasaí, ag 150 csm. Ansin, comhdhlúthaíonn sí chun scamaill á dhéanamh, agus bíonn sí ina cuid thábhachtach de imoibrithe ceimiceacha san atmaisféar agus cuidíonn sí leis an téamh domhanda. Luaitear í mar an ghníomhaire lárnach is mó a bhíonn freagrach as luathtéamh Mharsa, le meastacháin na tiúchana san ísealatmaisféar chomh hard le 100 csm, cé nach mbíonn sí ann ach amháin i méideanna rian ann bheag. Ar Véineas agus Mars agus ar an Domhan araon, creidtear gurb é sceitheadh gáis bholcánaigh a phríomhfhoinse. Bíonn 90 % dé-ocsaíd sulfair san atmaisféar Io agus ceaptar go mbíonn rianméideanna freisin in atmaisféar Iúpatair.

Tagairtí
[cuir in eagar | athraigh foinse]- ↑ Tá ort na shonrú' 'teideal = agus' 'url = nuair a úsáideann {{ lua idirlín}}."".
- ↑ "Chemical bonding in oxofluorides of hypercoordinatesulfur" (1997). Journal of the Chemical Society, Faraday Transactions 93 (13): 2247–2254. doi:.
