Neodrúchán (ceimic)

Trí thurgnaimh sa cheimic, in imoibriú aigéad–bunanna faightear amach go gcailleann aigéad agus bun a n-airíonna sainiúla nuair a imoibríonn siad le chéile sa chomhréir cheart, Tugtar imoibriú neodrúcháin nó imoibriú neodraithe air seo, mar go mbíonn toradh neodrach ann (ní bhíonn sé aigéadach ná bunata), ós rud é nach bhfuil aon éifeacht ag an tuaslagán a fhoirmítear ar litmeas.
In imoibriú in uisce, mar thoradh ar neodrúchán, ní bhíonn barraíocht ian hidrigine nó hiodrocsaíde fágtha sa tuaslagán. Braitheann pH an tuaslagáin neodraithe ar neart aigéadaigh na n-imoibreán.
An bhrí atá le "neodrúchán"
[cuir in eagar | athraigh foinse]I gcomhthéacs imoibriú ceimiceach úsáidtear an téarma neodrúchán nó neodrú le haghaidh imoibrithe idir aigéad agus bun nó alcaile. Go stairiúil, léiríodh an t-imoibriú seo mar
aigéad + bun (alcaile) → salann + uisce
Mar shampla:
- HCl + NaOH → NaCl + H2O
Tá an ráiteas bailí fós fad is go dtuigtear go bhfuil na substaintí atá i gceist faoi réir díthiomsaithe, a athraíonn staid ianúcháin na ndúl. Úsáidtear an treoshaighead, →, toisc go bhfuil an t-imoibriú iomlán críochnaithe, is é sin, imoibriú cainníochtúil is ea an neodrúchán. Tá sainmhíniú níos ginearálta bunaithe ar theoiric Brønsted-Lowry maidir le haigéid agus bunanna.
- AH + B → A + BH
Fágtar luchtanna leictreacha ar lár ó sloinn chineálacha mar seo, toisc go bhféadfadh nó nach bhféadfadh lucht leictreach a bheith ag gach speiceas A, AH, B, nó BH. Soláthraíonn neodrú an aigéid sulfaraigh sainshampla dúinn. Is féidir dhá pháirtimoibrithe neodrúcháin a bheith i gceist sa chás seo.
- H2SO4 + OH− → HSO4−+ H2O
- HSO4− + OH− → SO42−+ H2O
- Overall: H2SO4 + 2OH− → SO42−+ 2H2O
Tar éis an aigéid AH a neodrú níl aon mhóilíní den aigéad (nó iain hidrigine a tháirgtear trí dhí-an mhóilín a dhíthiomsú) fágtha sa tuaslagán.
Nuair a neodraítear aigéad caithfidh méid an bhuin a chuirtear leis a bheith cothrom leis an méid aigéid atá i láthair i dtosach. Deirtear gurb é méid an bhuin seo an méid coibhéiseach. I dtoirtmheascadh aigéid le bun, is féidir pointe na neodrúcháin a thabhairt ar an bpointe coibhéise freisin. Cuirtear nádúr cainníochtúil an imoibrithe neodraithe in iúl go háisiúil i dtéarmaí thiúchan na n-aigéad agus na n-alcaile. Ag pointe na coibhéise:
Go ginearálta, i gcás an aigéid AHn ag tiúchan c1 a imoibríonn le bun B (OH)m ag tiúchan c c2, bíonn gaol ag na toirteanna le chéile trí:
- n v1 c1 = m v2 c2
Seo a leanas sampla de bhun atá á neodrú ag aigéad.
- Ba(OH)2 + 2H+ → Ba2+ + 2H2O
Tá feidhm ag an gcothromóid chéanna a bhaineann le tiúchan aigéad agus bunanna. Níl coincheap an neodraithe teoranta d'imoibrithe sa tuaslagán. Mar shampla, is imoibriú neodrúcháin é imoibriú aolchloiche le haigéad mar aigéad sulfarach.
- [Ca,Mg]CO3(s) + H2SO4(aq) → (Ca2+, Mg2+)(aq) + SO42−(aq) + CO2(g) + H2O
Tá imoibrithe den sórt sin tábhachtach i gceimic ithreach.
Aigéid láidre agus bunanna láidre
[cuir in eagar | athraigh foinse]Aigéad láidir is ea aigéad atá díthiomsaithe go hiomlán i dtuaslagán uiscí. Mar shampla, is aigéad láidir é aigéad hidreaclórach, HCl.
- HCl(aq) → H+(aq) + Cl−(aq)
Is bun láidir é bun atá díthiomsaithe go hiomlán i dtuaslagán uiscí. Mar shampla, is bun láidir é hiodrocsaíd sóidiam, NaOH.
- NaOH(aq) → Na+(aq) + OH−(aq)
Dá bhrí sin, nuair a imoibríonn aigéad láidir le bun láidir is féidir an t-imoibriú neodrúcháin a scríobh mar
- H+ + OH− → H2O
Mar shampla, san imoibriú idir aigéad hidreaclórach agus hiodrocsaíd sóidiam ní ghlacann na hiain sóidiam agus clóiríd, Na+ agus Cl− aon pháirt san imoibriú. Tá an t-imoibriú comhsheasmhach le shainmhíniú Brønsted - Lowry, mar i ndáiríre tá an ian hidrigine ann mar an ian ocsóiniam, ionas gur féidir an t-imoibriú neodrúcháin a scríobh mar
- H3O+ + OH− → H2O + H2O → 2 H2O
Nuair a neodraítear aigéad láidir le bun láidir níl aon ian hidrigine sa bhreis fágtha sa tuaslagán. Deirtear go bhfuil an tuaslagán neodrach toisc nach bhfuil sé aigéadach ná alcaileach. Tá pH tuaslagáin den sórt sin gar do luach 7; braitheann an luach cruinn pH ar theocht an tuaslagáin.
Is imoibriú eisiteirmeach é an neodrú. Is é −57.30 kJ / mol an t-athrú caighdeánach eantalpachta don imoibriú H+ + OH− → H2O.
Cóireáil chainníochtúil
[cuir in eagar | athraigh foinse]Baineann an téarma díthiomsaithe go hiomlán do thuaslagáit nuair a bhíonn tiúchan tháirgí a dhíthiomsú faoi bhun teorainneacha na brathadóireachta, is é sin, nuair a bhíonn tiúchan na dtáirgí ró-íseal le tomhas. Go cainníochtúil, cuirtear é seo in iúl mar log K <-2, nó i roinnt téacsanna log K <-1.76. Ciallaíonn sé seo nach féidir luach an tairisigh dhíthiomsúcháin a fháil ó thomhais thurgnamhacha. Is féidir an luach a mheas go teoiriciúil, áfach. Mar shampla, meastar luach log K ≈ -6 do chlóiríd hidrigine i dtuaslagán uiscí ag teocht an tseomra.[1] Dá bhrí sin, féadfaidh comhdhúil cheimiceach í féin a iompar mar aigéad láidir i dtuaslagán nuair a bhíonn a thiúchan íseal. agus mar aigéad lag nuair a bhíonn a thiúchan an-ard. Is sampla é an t-aigéad sulfarach de chomhdhúil den sórt sin.
Aigéid laga agus bunanna láidre
[cuir in eagar | athraigh foinse]Aigéad lag is ea aigéad nach ndíthiomsaíonn go hiomlán nuair a thuaslagtar é in uisce. Ina áit sin cruthaítear cumasc cothromaíochta.
- AH + H2O ⇌ H3O+ + A−
Is sampla d’aigéad lag é an t-aigéad eatánóch. Níl pH an tuaslagáin neodraithe gar do 7, mar atá le haigéad láidir, ach braitheann sé ar an tairiseach díthiomsúcháin aigéid, KA, den aigéad. Is féidir an pH ag an gcríochphointe nó ag an bpointe coibhéise i dtoirtmheascadh a ríomh go héasca. Ag an gcríochphointe bíonn an t-aigéad neodraithe go hiomlán agus mar sin tá an tiúchan anailíseach den ian hidrigine, Th, a náid agus tá tiúchan an bhuin chomhchuingigh,A−, cothrom le tiúchan anailíseach an aigéid; ag scríobh ; AH don aigéad, [A−] = TA. Nuair a bhíonn tuaslagán d'aigéad, AH, ag cothromaíocht, de réir sainmhínithe tá baint ag an slonn leis na tiúchain
[A−][H+] = Ka[HA]; pKa = −log10Ka
Fágtar an tuaslagóir (.i. uisce) ar lár ón slonn sainitheach ar an bhfoshuíomh go bhfuil a thiúchan i bhfad níos mó ná an tiúchan d’aigéad tuaslagtha, [H2O] >> TA.
- Kw = [H+][OH−]; pKw = −log10Kw
is féidir an chothromóid do mhais-chothromaíocht sna hiain hidrigine a scríobh ansin mar
- TH = [H+] + Ka[A−][H+] − Kw/[H+]
áit a léiríonn K w an tairiseach féin-díthiomsúcháin uisce, K W = [H + ] [OH - ]. Tá an téarma K w / [H + ] cothrom le tiúchan na n-ian hiodrocsaíde. Ag neodrú, tá T H nialas. Tar éis an dá thaobh den chothromóid a iolrú faoi [H + ], bíonn sé
[H+]2 + KaTA[H+]2 − Kw = 0
agus, tar éis atheagrú agus logartaim a thógáil,
- pH = pKw − log (1 + TA/Ka)
Le tuaslagáin chaolaithe den aigéad is ionann an téarma le comhfhogasú maith 1 + TA/Ka le TA/Ka .
pH = 1/2 pKw - 1/2(pKA + log TA)
Míníonn an chothromóid seo na fíricí seo a leanas:
- Braitheann an pH ag an gcríochphointe go príomha ar neart an aigéid, pKa.
- Laghdaíonn an pH ag an gcríochphointe le tiúchan méadaitheach an aigéid TA.
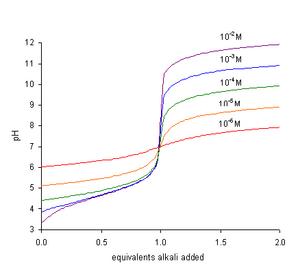
I toirtmheascadh aigéad lag le bun láidir ardaíonn an pH níos géire de réir mar a dhéantar teagmháil leis an gcríochphointe. Bíonn fána an chuar pH maidir ar a uasmhéid méid an thoirtmheascthóra, nuair atá an pH uimhriúilchothrom le luach pKa. Tarlaíonn an críochphointe ag pH níos mó ná 7. Dá bhrí sin, is é an táscaire is oiriúnaí le húsáid ná ceann, cosúil le feanóltailéin, a athraíonn dath ag ardluach-pH.[2]
Bunanna laga agus aigéid láidre
[cuir in eagar | athraigh foinse]Nuair a imoibríonn aigéad lag le méid coibhéiseach de bhun lag ní tharlaíonn neodrú iomlán.
AH + B ⇌ A− + BH+
Braithfidh tiúchain na speiceas i gcothromaíocht lena chéile ar an tairiseach cothromaíochta, K, don imoibriú, ar féidir a shainiú mar seo a leanas.
[A−][BH+] = K[AH][B]
I bhfianaise na tairisigh tiomsaithe don aigéad (Ka) agus don bhonn (Kb).
- A− + H+ ⇌ AH; [AH] = Ka[A−][H+]
- B + H+ ⇌ BH+; [BH+] = Kb[B][H+]
leanann sé go bhfuil K = Ka/Kb.
Ní féidir aigéad lag a neodrú le bun lag, agus a mhalairt.
Feidhmeanna
[cuir in eagar | athraigh foinse]Úsáidtear modhanna toirtmheasctha i gcomhair aigéid nó bunanna a anailísiú chun na tiúchana anaithnid a aimsiú. Is féidir méadar pH nó táscaire pH a thaispeánann críochphointe an neodraithe trí athrú datha ar leith a úsáid. Tugann ríomhanna simplí stócaiméadracha le toirt aitheanta an anaithnid agus an toirt aitheanta agus mólaracht den cheimiceán breise mólaracht an anaithnid duit. I gcóireáil fuíolluisce, is minic a chuirtear modhanna neodraithe ceimiceacha i bhfeidhm chun an damáiste a d’fhéadfadh eisilteach a dhéanamh a laghdú, nuair a scaoiltear isteach sa gcomhshaol é. Maidir le rialú pH, baintear leas as na gceimiceáin choitianta seo a leanas; carbónáit chailciam, ocsaíd chailciam, hiodrocsaíd mhaignéisiam, agus décharbónáit sóidiam. Braitheann an ceimiceán a úsáidtear le haghaidh neodraithe ar shonraí na faidhbe atá i gceist.
Is iomaí úsáid a bhaintear as imoibrithe neodraithe ar imoibrithe aigéad-alcaile iad. Úsáid an-choitianta is ea táibléid fhrithaigéadacha. Tá siad seo deartha chun an iomarca aigéad gastrach sa bholg (HCl) a d'fhéadfadh a bheith ag cruthú míchompord sa bholg nó san éasafagas íochtarach a neodrú. Is féidir é seo a leigheas freisin trí dhécharbónáit sóidiam a ionghabháil (NaHCO3). Úsáidtear décharbónáit sóidiam má tharlaíonn doirteadh ceimiceán nó i saotharlanna. I sintéis cheimiceach nana-ábhar, is féidir teas ón imoibriú neodraithe a úsáid chun an dhí-ocsaídiúcháin ceimicigh de réamhtheachtaithe miotail a éascú.
I gconair an díleá freisin, úsáidtear imoibrithe neodraithe nuair a bhogtar bia ón mbolg go dtí an stéig bheag. Ionas go bhféadfar na cothaithigh a ionsú tríd an mballa stéigigh, tá gá le timpeallacht alcaileach, agus mar sin táirgeann an paincréas décharbónáit fhrithaigéadach chun go dtarlódh an claochlú seo.
Úsáid choitianta eile, cé nach bhfuil sé chomh forleathan ar eolas, is ea leasacháin agus rialú pH ithreach. Is féidir aol teilgthe (hiodrocsaíd chailciam) nó aolchloch (carbónáit chailciam) a tharraingt isteach in ithir atá ró-aigéadach d’fhás plandaí. Déantar leasacháin a fheabhsaíonn fás plandaí trí aigéad sulfarach (H2SO4) nó aigéad nítreach (HNO3) a neodrú le gás amóinia (NH3), ag déanamh sulfáit amóiniam nó níotráit amóiniam. Is salainn iad seo a úsáidtear sa leasachán.
Go tionsclaíoch, féadfaidh fotháirge de dhó guail, gás dé-ocsaíde sulfair, dul le gal uisce san aer chun aigéid sulfaraigh a tháirgeadh, a thiteann mar bháisteach aigéadach. Chun cosc a chur ar an dé-ocsaíd sulfair a scaoileadh, glanann gléas ar a dtugtar sciúrthóir an gás a chruachadh ó chruacha deataigh. Séideann an gléas seo carbónáit chailciam isteach sa chuasán dó ar dtús air a dhíscaoileann sé go dtí ocsaíd chailciam (aol) agus dé-ocsaíd charbóin. Ansin imoibríonn an aol seo leis an dé-ocsaíd sulfair a tháirgtear ag foirmiú suilfít chailciam. Instealltar fuaidreán aoil isteach sa mheascán ansin chun draoibe a tháirgeadh, a bhaintear an sulfáit chailciam agus aon dé-ocsaíd sulfair neamh-imoibrithe atá fágtha.
Naisc sheachtracha
[cuir in eagar | athraigh foinse]- UC Berkeley video lecture on acid-base reactions
- Acid-base Physiology: an on-line text
- John W. Kimball's online Biology book section of acid and bases.
- Lavoisier, Davy, and Liebig theories at the ChemTeam Tutorials
- Tabla de constantes de equilibrio Ka y Kb de ácidos y bases.
Tagairtí
[cuir in eagar | athraigh foinse]- ↑ "Acidity of Strong Acids in Water and Dimethyl Sulfoxide" (as EN) (2016-05-06). The Journal of Physical Chemistry A 120 (20): 3663–3669. doi:. ISSN 1089-5639. PMID 27115918. Bibcode: 2016JPCA..120.3663T.
- ↑ Steven S. Zumdahl (2009). "Chemical Principles": 319–324. New York: Houghton Mifflin Company.
