Toirtmheascadh

Is modh coiteann saotharlainne é an toirtmheascadh (ar a dtugtar tíotraiméadracht agus anailís thoirtmheasach freisin) chun anailís chainníochtúil cheimiceach a dhéanamh chun tiúchan na hanailíte aitheanta (an chomhdhúil atá le hanailísiú) a thomhas. Ullmhaítear imoibrí, ar a dtugtar an toirtmheascthóir, mar thuaslagán caighdeánach de thiúchan agus toirt aitheanta. Imoibríonn an toirtmheascthóir le tuaslagán den anailít chun tiúchan na hanailíte a chinneadh. Tugtar toirt an thoirtmheasctha ar mhéid an thoirtmheascthóra a d'imoibrigh leis an anailít.
Stair agus sanasaíocht[cuir in eagar | athraigh foinse]
Tagann an focal "tiltre "(Gaeilge: títear) ón bhfocal Fraincise (1543), rud a chiallaíonn cion an óir nó an airgid i mboinn airgid nó i saothair óir nó airgid; .i., tomhas míne nó íonachta. Níos déanaí, rinneadh "titre" de "tiltre",[1] agus ansin chiallaigh sé "míne an óir chóimhiotalaithe",[2] agus ansin "tiúchan substainte i sampla ar leith".[3] Sa bhliain 1828, d’úsáid an poitigéir Francach Joseph Louis Gay-Lussac "titre" ar dtús mar bhriathar (titrer), rud a chiallaíonn “chun tiúchan substainte i sampla ar leith a chinneadh”.[4]
Ag deireadh an 18ú haois, a thosaigh anailís toirtmhéadrach sa Fhrainc. D’fhorbair François-Antoine-Henri Descroizilles an chéad buiréad (a bhí cosúil le sorcóir grádaithe) sa bhliain 1791. D’fhorbair Gay-Lussac leagan feabhsaithe den bhuiréad a chuimsigh taobhghéag, agus chum sé na téarmaí "pipette" (Gaeilge: pípéad) agus "burette" (Gaeilge: buiréad) i bpáipéar sa bhliain 1824 ar chaighdeánú thuaslagáin indeagó.[5] The first true burette was invented in 1845 by the French chemist Étienne Ossian Henry (1798–1873).[6][7][8][9] Ba é an poitigéir Francach Étienne Ossian Henry (1798-1873) a chum an chéad fhíorbhuiréad sa bhliain 1845. Tháinig feabhas mór ar an modh agus an tóir a bhí ar anailís toirtmhéadrach de bharr Karl Friedrich Mohr, a athdhearadh an buiréad i bhfoirm shimplí agus áisiúil, agus a scríobh an chéad téacsleabhar ar an ábhar, Lehrbuch der chemisch-analysistischen Titrirmethode (Téacsleabhar de mhodhanna toirtmheasctha na ceimice anailíse.), a foilsíodh sa bhliain 1855.[10][11]
Modh oibre[cuir in eagar | athraigh foinse]

Tosaíonn toirtmheascadh tipiciúil le heascra nó fleascán Erlenmeyer ina bhfuil méid an-bheacht den anailít agus méid beag táscaire (mar shampla feanóltailéin) a chuirtear faoi bhuiréad calabraithe nó steallaire píopaitireacht ceimice ina bhfuil an toirtmheascthóir.[12] Ansin cuirtear méideanna beaga den toirtmheascthóir leis an anailít agus leis an táscaire go dtí go n-athraíonn dath an táscaire mar fhreagairt ar thairseach sáithithe an toirtmheascthóra, rud a léiríonn go bhfuil críochphointe an thoirtmheasctha sroichte, rud a chiallaíonn go bhfuil méid an thoirtmheascthóra agus méid na anailíte atá i láthair ar mheá chothrom, de réir an imoibrithe idir an dá cheann. Ag brath ar an gcríochphointe atá ag teastáil, is féidir le braon aonair nó níos lú ná braon amháin den thoirtmheascthóir an difríocht idir athrú buan agus sealadach sa táscaire a dhéanamh.
Teicnící ullmhúcháin[cuir in eagar | athraigh foinse]
Éilíonn toirtmheascadh tipiciúil go bhfuil an toirtmheascthóir agus an anailít i bhfoirm leachtach (tuaslagán). Cé go dtuaslagtar solaid i dtuaslagán uiscí de ghnáth, úsáidtear tuaslagóirí eile mar aigéad aicéiteach oighreach nó eatánól chun críocha speisialta (mar atá sa pheitriceimic) a dhéanann speisialtóireacht sa pheitriliam.[13] Is minic a chaolaítear anailítí tiubhaithe chun cruinnis a fheabhsú.
Éilíonn go leor toirtmheascadh neamh-aigéad-bunanna pH seasmhach le linn an imoibrithe. Dá bhrí sin, féadfar tuaslagán maolánach a chur leis an choimeádán toirtmheasctha chun an pH a choinneáil.[14]
I gcásanna nuair a fhéadfaidh dhá imoibreán i sampla imoibriú leis an toirtmheascthóir agus nach bhfuil ach ceann amháin mar an anailít atá ag teastáil, féadfar tuaslagán masctha ar leithligh a chur leis an cuasán imoibrithe a chuireann deireadh le héifeacht an iain nach bhfuil ag teastáil.[15]
D’fhéadfadh sé go n-éileodh roinnt imoibrithe ocsaídiúcháin is dí-ocsaídiúcháin (ocsdí) an tuaslagán samplach a théamh agus é a thoirtmheascadh agus an tuaslagán fós te chun an ráta imoibrithe a choinneáil.[16]
Cuair toirtmheasctha[cuir in eagar | athraigh foinse]
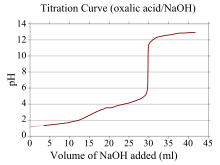
Is éard atá i gcuar toirtmheasctha ná graf a úsáidtear le linn toirtmheascadh chun a bpointe coibhéise a chinneadh. Is ionann a x-chomhordanáid agus toirt an toirtmheascthóra a cuireadh leis ó thús an toirtmheasctha, agus arb ionann a y-chomhordanáid de thiúchan na hanailíte ag an gcéim chomhfhreagrach den toirtmheascadh (i toirtmheascadh aigéad-bunanna, is ionann an y-chomhordanáid de ghnáth agus pH an tuaslagáin)[17] I toirtmheascadh aigéad-bun, is ionann an cuar toirtmheasctha agus neart an aigéid agus an bhuin chomhfhreagraigh. I gcás aigéid láidir agus bun láidir, beidh an cuar réasúnta réidh agus an-ghéar in aice leis an bpointe coibhéise. Mar gheall air seo, bíonn athrú mór ar an pH mar thoradh ar athrú beag ar thoirt an thoirtmheascthóra in aice leis an bpointe coibhéise agus bheadh go leor táscairí oiriúnach (mar shampla litmeas, feanóltailéin nó brómaitíomól gorm).
Más aigéad nó bun lag é imoibrí amháin agus aigéad nó bun láidir sa cheann eile, tá an cuar toirtmheasctha neamhrialta agus aistríonn an pH níos lú le breiseanna beaga den toirtmheascthóir gar don phointe coibhéise. Mar shampla, sa chuar toirtmheasctha don toirtmheascadh idir aigéad ocsalach (aigéad lag) agus hiodrocsaíd sóidiam (bun láidir), atá sa phictiúr thuas. Tarlaíonn an pointe coibhéise idir pH 8-10, rud a léiríonn go bhfuil an tuaslagán bunata ag an bpointe coibhéise agus go mbeadh táscaire cosúil le feanóltailéin oiriúnach. Iompraíonn cuair toirtmheasctha a fhreagraíonn do bhunanna laga agus aigéid láidre ar an gcaoi chéanna, agus tá an tuaslagán aigéadach ag an bpointe coibhéise agus bíonn táscairí mar oráiste meitile agus brómaitíomól gorm níos oiriúnaí.
Tá cuair toirtmheasctha ag toirtmheascaí idir aigéad lag agus bun lag atá an-neamhrialta. Mar gheall air seo, ní fhéadfaidh aon táscaire cinnte a bheith oiriúnach agus is minic a úsáidtear méadar pH chun monatóireacht a dhéanamh ar an imoibriú.[18] Tugtar feidhm shiogmóideach ar an gcineál feidhme is féidir a úsáid chun cur síos a dhéanamh ar an gcuar.
Cineálacha toirtmheascadh[cuir in eagar | athraigh foinse]
Tá go leor cineálacha toirtmheasctha ann le nósanna imeachta agus spriocanna éagsúla. Is iad na cineálacha toirtmheasctha cáilíochtúla is coitianta ann ná toirtmheascadh aigéad-bun agus bon aigéad agus toirtmheascadh ocsaidí.
Toirtmheascadh aigéad-bun

| Táscaire | Dath ar thaobh aigéadach | Raon an athraithe datha (pH) |
Dath ar an taobh bunata |
|---|---|---|---|
| Vialait mheitile | Buí | 0.0–1.6 | Vialait |
| brómaifeanóil gorm | Buí | 3.0–4.6 | gorm |
| Oráiste meitile | Dearg | 3.1–4.4 | Buí |
| Dearg meitile | Dearg | 4.4–6.3 | Buí |
| Litmeas | Dearg | 5.0–8.0 | Gorm |
| Brómaitíomól gorm | Buí | 6.0–7.6 | Gorm |
| Feanóltailéin | Éadathach | 8.3–10.0 | Bándearg |
| Alasairín buí | Buí | 10.1–12.0 | Dearg |
Tagairtí[cuir in eagar | athraigh foinse]
- ↑ Ortolang: "titre" (in French): "4. a) 1543 tiltre « proportion d'or ou d'argent dans les monnaies, dans les ouvrages d'or et d'argent »
- ↑ Etymology On Line: titrate
- ↑ WordReference: titre and titer
- ↑ "Essai des potasses du commerce" (as fr) (1828). Annales de Chimie et de Physique 39: 337–368. In footnote (1) of p. 340, Gay-Lussac first uses titre as a verb: "Il leur serait plus facile de titrer l'acide sulfurique normal au moyen du carbonate de soude ou de potasse pur; … " ([Agus tiúchan aigéad sulfarach á chinneadh] bheadh sé níos éasca dóibh gnáth-aigéad sulfarach a thoirtmheascadh trí shóidiam íon nó carbónáit photaisiam;…)
- ↑ "Instruction sur l'essai du chlorure de chaux" (as fr) (1824). Annales de chimie et de physique 26: 162–175. On pp. 170–171, Gay-Lussac describes various figures that appear in a plate (illustration) that accompanies the article. From p. 170: " F, petite mesure ou pipette de 2 ½ centimètres cubes, … " (F, small measure or "pipette" of 2 ½ cc., … ) From p. 171: " I, burette destinée à mesurer la teinture d'épreuve: … " (I, "burette" intended to measure the test dye: … )
- ↑ "Nouvelles expériences sur l'essai des potasses du commerce et appareil dit potassimètre pour l'effectuer" (as fr) (1845). Journale de Pharmacie et de Chimie 7: 214–222. A sketch of Henry's burette appears on p. 218.
- ↑ "The history of chemical laboratory equipment" (1986). Periodica Polytechnica Chemical Engineering 30 (1–2): 77–95. See p. 87.
- ↑ "History of Analytical Chemistry" (1966). Oxford, England: Permagon Press.
- ↑ "L'analyse volumétrique de 1790 à 1860. Caractéristiques et importance industrielle. Evolution des instruments." (as fr) (1971). Revue d'histoire des sciences 24 (1): 25–44. doi:. From p. 38: " … il préfigure bien ses descendants actuelles … " ( … it [i.e., Henry's burette] foreshadows well its modern descendants … )
- ↑ Rosenfeld, L. (1999). "Four Centuries of Clinical Chemistry": 72–75. CRC Press.
- ↑ "Lehrbuch der chemisch-analytischen Titrirmethode …, part 1" (as de) (1855): 2–20. Braunschweig, (Germany): Friederich Vieweg und Sohn. Page 3 shows Mohr's burette; page 12 shows a burette with a glass stopcock (Glasshahn).
- ↑ da Nobrega Gaiao, E., Martins, V. L., da Silva Lyra, W., de Almeida, L. F., da Silva, E. C., & Araújo, M. C. U. (2006). Digital image-based titrations. Analytica Chimica Acta, 570(2), 283-290. doi: 10.1016/j.aca.2006.04.048. https://www.academia.edu/download/53035363/4_-_Digital_image-based_titrations_2006.pdf[nasc briste go buan]
- ↑ Matar, S. (2001). "Chemistry of Petrochemical Processes". Gulf Professional Publishing.
- ↑ Verma, Dr. N.K.. "Comprehensive Chemistry XI": 642–645. New Dehli: Laxmi Publications.
- ↑ Patnaik, P. (2004). "Dean's Analytical Chemistry Handbook": 2.11–2.16. McGraw-Hill Prof Med/Tech.
- ↑ Walther, J.V. (2005). "Essentials of Geochemistry": 515–520. Jones & Bartlett Learning.
- ↑ Reger, D.L. (2009). "Chemistry: Principles and Practice": 684–693. Cengage Learning.
- ↑ Bewick, S. (2009). "CK12 Chemistry": 794–797. CK-12 Foundation.
